Онкология: Новая Эра Понимания и Борьбы с Раком

Борьба с Раком: Вчера, Сегодня, Завтра
В борьбе с раком мы, кажется, застряли в прошлом. Несмотря на то что к 2050 году число смертей от онкологических заболеваний во всем мире, по прогнозам, почти удвоится, наш подход к оценке рисков, профилактике и лечению рака по-прежнему напоминает методы 1960-х годов [1]. Между тем, за более чем полвека наука совершила колоссальные прорывы в понимании биологических механизмов, способных остановить развитие рака, но эти знания до сих пор не нашли должного применения в клинической практике.
Современные достижения позволяют нам определять индивидуальные риски развития рака, с беспрецедентной точностью ставить диагноз на самых ранних стадиях и применять гораздо более безопасные и эффективные методы лечения. Учитывая, что почти половина населения Земли столкнется с раком когда-либо в течение жизни, невозможно добиться значительного увеличения продолжительности здоровой жизни, не взяв это заболевание под контроль.
Долгое время мы вели "войну" с раком, и, к сожалению, слишком многие эту битву проигрывали. Но настало время отказаться от милитаристских метафор. Это не операция грубой силы. Для увеличения продолжительности здоровой жизни требуется интеллектуальное применение всей нашей обширной базы знаний о раке, которая охватывает пять ключевых направлений:
- Образ жизни: Глубокое понимание влияния образа жизни на риск развития рака и его профилактику.
- Омиксные технологии: Использование геномики, протеомики и других "омиксных" данных для персонализированной диагностики и лечения.
- Искусственный интеллект (ИИ): Применение ИИ для анализа огромных объемов медицинских данных, выявления закономерностей и прогнозирования исходов.
- Клеточные технологии: Разработка и внедрение клеточных терапий, включая иммунотерапию и CAR-T клеточную терапию.
- Лекарства и вакцины: Создание новых, более целенаправленных препаратов и профилактических вакцин.
Сегодня мы знаем о раке так много, что можем совершить настоящую революцию в медицинской практике. Большая часть этих знаний уже готова к применению. Чтобы глубже разобраться в этом, давайте в первую очередь рассмотрим, как обстоят дела с нашим пониманием биологии рака.
Загадка Рака: Три Теории Происхождения
Как возникает рак? Этот вопрос десятилетиями будоражит умы ученых, и сегодня мы можем выделить три основные, но не взаимоисключающие теории, каждая из которых по-своему объясняет коварство этого заболевания.
1. Теория Соматических Мутаций: Игра Генов и Времени
В основе первой теории лежит идея о том, что рак зарождается в наших генах. Так называемые "онкогены" приобретают мутации, которые либо их активируют, либо лишают клетки способности подавлять опухоли. Представьте наш геном как огромную книгу из трех миллиардов "букв". При каждом делении клетки в ней неизбежно возникают тысячи ошибок. С возрастом эти мутации накапливаются со скоростью от пятнадцати до пятидесяти в каждой клетке в год [2,3,4].
Конечно, большинство из них безвредны. Однако ученые обнаружили более пятисот генов, которые при мутации с гораздо большей вероятностью приводят к раку. Их называют драйверными генами, потому что, мутируя, они буквально "запускают" рост клеток и могут спровоцировать появление раковых клеточных клонов, ведущих к болезни [5,6,7]. Интересно, что эти процессы совпадают с характерными признаками старения: нестабильностью генома, истощением стволовых клеток, дисфункцией митохондрий и нарушением утилизации "сломанных" белков и стареющих клеток. Это наводит на мысль о тесной связи между старением и риском развития рака.
2. Тканевая Теория: Роль Окружения
В отличие от генетической, вторая теория фокусируется на тканевом окружении. Она предполагает, что рак возникает локально, там, где происходит канцерогенное воздействие, нарушается целостность тканей и наблюдается аномальный иммунный ответ. Это означает, что не только внутренние поломки в генах, но и внешние факторы, влияющие на наши ткани, играют ключевую роль в развитии заболевания [8,9,10].
3. Теория "Невезения": Случайность или Закономерность?
Третья теория, хоть и звучит несколько фаталистично, известна как "невезение". Она приписывает возникновение рака случайным ошибкам в процессе репликации стволовых клеток. Учитывая огромную частоту деления клеток в нашем организме, вероятность таких случайных сбоев не так уж и мала [11,12,13].
Взаимосвязь Теорий: Полная Картина
Принимая во внимание удивительную частоту и разнообразие форм рака, не будет удивительным, если все эти механизмы, так или иначе, приводят к развитию заболевания. Возможно, именно их взаимодействие создает ту сложную и многогранную картину, которую мы называем раком. Понимание каждой из этих теорий помогает нам приблизиться к разгадке этой одной из самых серьезных угроз для здоровья человечества.
Пространственная Биология Открывает Новые Горизонты в Понимании Рака
Достижения в пространственной биологии кардинально меняют наше представление о развитии рака. Теперь мы можем не просто наблюдать за опухолью, но и понимать, как она эволюционирует во времени и пространстве, благодаря секвенированию сотен тысяч, а то и миллионов отдельных клеток из раковой ткани. Это позволяет нам детально изучать их ДНК, РНК, белки, метаболиты и даже особенности метилирования.
Анализ таких гигантских объемов данных стал возможен лишь благодаря искусственному интеллекту (ИИ) и новым, сложным алгоритмам. Эта утонченная пространственно-временная характеристика, которую можно визуализировать в 3D, позволяет нам отслеживать не только основные клоны раковых клеток, но и их субклоны. Более того, мы теперь можем видеть новые белки, появляющиеся на их поверхности, известные как неоантигены — ключевые цели для иммунотерапии.
Тайны Микроокружения и Метастазирования
Одним из самых значимых открытий в этой области стало понимание важности микроокружения опухоли. Это не просто беспорядочная масса клеток, а сложная, нераковая экосистема, которая окружает опухоль. Она состоит из иммунных клеток, кровеносных сосудов и обширной сети белков и других молекул, называемой внеклеточным матриксом. Эти компоненты играют важнейшую роль в росте, выживании и распространении раковых клеток.
Благодаря 3D-картам пространственной биологии мы теперь можем визуализировать не только само микроокружение опухоли, но и отслеживать метастатическое распространение раковых клеток в другие органы. Это открывает новые перспективы для разработки методов предотвращения метастазирования – главной причины смертности от рака.
Эволюция Рака: От Мутации к Диагнозу
Представьте себе, как с течением времени в наших клетках накапливаются мутации. В какой-то момент одна из этих мутаций становится драйверной, давая начало раковой клетке-основателю. С этого момента начинается активное деление и формирование различных клонов опухоли, которые развиваются еще до того, как будет поставлен диагноз.
Пространственная биология даёт нам беспрецедентную возможность заглянуть в самые глубины развития рака, что позволит нам разрабатывать более точные, персонализированные и эффективные стратегии борьбы с этим заболеванием.
В прошлом, глядя на слайд биопсии опухоли, мы могли лишь констатировать, что раковая ткань человека гетерогенна, то есть неоднородна. Это было похоже на попытку понять сложную картину, видя лишь отдельные мазки. Но теперь пространственная биология погружается глубже, раскрывая эволюционный фон ткани — своего рода клеточную машину времени.
Представьте себе: теперь мы можем помечать клетки "штрих-кодами", чтобы отслеживать их судьбу. Мы секвенируем их митохондриальную ДНК, определяем относительное преобладание опухолевых клонов с течением времени в разных частях тела. Более того, мы способны отличать злокачественные процессы от доброкачественных, таких как клональная пролиферация кроветворных стволовых клеток (гемопоэз). Это прорыв, позволяющий нам видеть не просто статичный снимок, а динамичную историю развития болезни.
Воспаление и Рак: Неожиданные Открытия
Давно известно, что примерно 25 процентам случаев рака предшествует хроническое воспаление в месте происхождения опухоли. Это как тлеющий огонь, который может разжечь пожар. Но недавно мы обнаружили нечто поразительное: определенный тип кишечных Т-клеток способен самостоятельно инициировать рак. Это открытие переворачивает наше представление о роли иммунной системы в развитии онкологических заболеваний [14,15,16].
Загадка PanINs: Предвестники Рака в Здоровых Людей
Примечательно, что пространственное картирование поджелудочной железы у здоровых взрослых выявило сотни крошечных предшественников рака, известных как PanIN (внутриэпителиальная неоплазия поджелудочной железы). Почти все они содержат мутации в KRAS — ведущем драйверном гене рака поджелудочной железы [17,18,19]. Это озадачивает: если у стольких людей присутствуют эти потенциально опасные образования, почему же не у всех развивается рак?
Этот вопрос открывает новые направления для исследований. Возможно, именно в механизмах, которые предотвращают развитие рака из PanINs, кроются ключи к новым стратегиям профилактики и лечения.
Наш Организм: Крепость с Уязвимыми Местами
Наш организм обладает удивительной, мощной защитой. Мы ежедневно подвергаемся воздействию множества угроз, но внутренняя система безопасности успешно справляется с ними. И именно благодаря новым высокотехнологичным методам картирования в сочетании с непосредственным опытом лечения пациентов, мы начинаем по-настоящему понимать, как работает эта защита и когда она даёт сбой.
Оказалось, что у женщины, у которой в 51 год был диагностирован рак молочной железы, предраковые клоныобнаруживались уже в 13 лет! У другой пациентки, чей диагноз рака прозвучал в 53 года, первые тревожные звоночки в виде раковых клонов были зафиксированы ещё в 17 лет. Эти данные ошеломляют: мы видим более чем десятилетний разрыв между появлением "драйверных" мутаций и формированием раковых клеток-основателей. И ещё один значительный промежуток времени проходит до момента постановки диагноза.
Рак: Долгий Путь, Полный Возможностей
Это значит, что путь к раку — это долгий путь. Это не внезапное нападение, а скорее медленное, постепенное развитие. И именно здесь кроется наша колоссальная возможность. У нас есть шанс обнаружить рак на предраковом состоянии, задолго до того, как он полностью сформируется и, что самое главное, до того, как он распространится из места своего происхождения в другие части тела.
Это понимание имеет огромное значение. Оно является ключом к разблокированию целого арсенала инструментов, которые мы можем использовать против всех основных возрастных заболеваний. Мы можем изменить их естественную историю, предотвращая их развитие за годы до того, как они проявятся во всей своей разрушительной силе. Представьте, сколько жизней мы могли бы спасти и улучшить, если бы могли вмешиваться на этом раннем, скрытом этапе!
Смертельный Путь Рака: Загадка Метастазирования
Мало кто умирает непосредственно от первичной опухоли. Настоящий приговор, к сожалению, выносит метастазирование — процесс, когда раковые клетки распространяются из одной части тела в другую. Именно метастазы становятся причиной гибели более 90% онкологических пациентов, приводя к отказу органов, порой даже при относительно небольшой "опухолевой нагрузке" [20,21,22].
Агрессия и Хитрость Метастатических Клеток
Клетки, способные инициировать метастазирование, приобретают удивительно агрессивные особенности. Они становятся настоящими мастерами маскировки и проникновения, научившись:
- Инвазивной миграции через кровеносные или лимфатические сосуды.
- Уклонению от иммунной системы, обманывая естественную защиту организма.
- Использованию эпигенетических изменений и метаболической адаптации для выживания в новых условиях.
Сегодня мы можем отслеживать эту коварную миграцию, беря кровь на анализ. В ней ищут циркулирующие опухолевые клетки (ЦОК) или бесклеточную опухолевую ДНК (боДНК). Эти методы позволяют буквально видеть, как рак "путешествует" по телу.
Рак Во Время Сна: Неожиданная Угроза
Недавние исследования принесли поразительные открытия. Оказалось, что миграция раковых клеток может быть невероятно агрессивной даже... во время сна! Исследование образцов крови пациентов с раком молочной железы, взятых в четыре и десять часов утра, показало, что 78% циркулирующих опухолевых клеток обнаруживались именно в период сна [23,24,25]. Конечно, это не означает, что нужно избегать сна для борьбы с метастазами. Но этот факт ярко демонстрирует, насколько изощренно рак способен использовать нашу собственную биологию, в том числе, возможно, влияя на активность иммунной системы.
Поражает, насколько оппортунистическими могут быть раковые клетки. Чтобы вызвать метастазирование, достаточно всего двух таких клеток на каждые десять тысяч, циркулирующих в крови [26,27,28]. Это подчеркивает хрупкость баланса и колоссальную опасность даже небольшого количества "бродячих" раковых агентов.
Коварство Рака: Как Опухоли Захватывают Наш Организм
К сожалению, коварство рака не знает границ. Порой даже здоровые клетки в некоторых органах экспрессируют на своей поверхности белки, которые, сами того не ведая, способствуют заселению раковых клеток, открывая им ворота в наш организм.
Лишь в последние годы мы начали понимать, насколько изощренно рак способен похищать нейроны и нейронные цепи, превращая некогда контролирующую систему в своего союзника. При этом наша нервная система, по иронии судьбы, тщетно пытается контролировать инициацию и прогрессирование болезни. Ещё в 2019 году ученые обнаружили прямые синапсы между определенным типом опухоли головного мозга и нейронами. Они сформулировали это открытие тремя словами: «Глиомы электрически активны» [29,30,31].Это поистине революционное наблюдение, подтвержденное и в исследованиях метастатического рака головного мозга, заложило прочный фундамент для относительно новой, но крайне важной области — нейробиологии рака.
Нейроны и Рак: Смертельный Альянс
Впоследствии стало ясно, что различные нейротрансмиттеры и факторы роста нервов, по-видимому, участвуют в формировании мембранных трубчатых соединений не только в головном, но и в спинном мозге и периферической нервной системе. Хуже того, некоторые мутации драйверных генов, например, p53, могут даже перепрограммировать нервные клетки, заставляя их секретировать адреналин и норадреналин [32,22,34]. Эти гормоны, в свою очередь, способны стимулировать рост опухоли.
Связи между нейронами и раковыми клетками способны не только ускорять рост опухоли, но и подавлять иммунный ответ. Было показано, что перепрограммирование симпатических нервов способствует истощению Т-клеток и препятствует эффективности иммунотерапии рака [35,36,37]. Это объясняет, почему некоторые виды рака так устойчивы к лечению.
Новые Надежды: Перепрофилированные Лекарства
Эти новые данные о роли связей между раковыми клетками и нейронами привели к запуску клинических испытаний по целому ряду типов рака — от мозга до грудной железы, от поджелудочной железы до простаты. В них используются различные перепрофилированные препараты, такие как пропранолол, клонидин или ботулинический токсин. Это открывает новые, ранее неизученные возможности для лечения.
Как прекрасно подытожили в своём научном обзоре пионеры нейроонкологии Ребекка Манкуси и Мишель Монье: «Хотя влияния на взаимодействия нервной системы и рака само по себе может быть недостаточным для искоренения опухоли, это может быть необходимым компонентом эффективных терапевтических режимовдля в настоящее время неизлечимых раковых заболеваний, таких как глиомы высокой степени злокачественности и рак поджелудочной железы» [38,39,40]. Это означает, что полное понимание и блокирование этих коварных связей может стать прорывом в лечении самых агрессивных форм рака.
Рак Поражает Не Только Нейроны, Но и Кровеносные Сосуды и Митохондрии
К сожалению, способности рака к "похищению" не ограничиваются нейронами. Десятилетиями исследователи ломали голову над тем, как опухоль умудряется захватывать кровеносные сосуды, чтобы обеспечить себе собственное кровоснабжение. Это привело к разработке антиангиогенных препаратов, таких как моноклональные антитела бевацизумаб, известный как Авастин, а также ингибиторы фактора роста эндотелия сосудов [41,42,43]. Эти средства были одобрены фармакологическими регуляторами и применяются при некоторых типах рака, но, увы, с переменным успехом. Борьба за лишение опухоли питания оказалась сложнее, чем казалось.
Двойной Удар: Похищение Митохондрий
Хотя мы давно знали о способности рака уклоняться от нашего иммунного ответа, наблюдение за отдельными клетками выявило ещё одно, совершенно поразительное измерение его хищнического поведения: рак способен красть митохондрии — энергетические станции клеток — у наших собственных Т-клеток! [44,45,46]
Это настоящий двойной удар: раковые клетки не только усиливают себя, получая дополнительную энергию, но и одновременно разрушают иммунный ответ, который преимущественно осуществляется Т-клетками. Представьте себе: рак не просто прячется от нашей защиты, он ослабляет её, забирая самые важные "топливные баки" у ключевых солдат нашего иммунитета.
Рак-Хамелеон: Смена Идентичности во Время Терапии
Раковые клетки могут даже менять свои драйверные гены и клеточную идентичность прямо во время терапии. Это было замечено при аденокарциноме легкого и аденокарциноме простаты. Указанное означает, что опухоль не статична; она эволюционирует, адаптируется и даже маскируется, чтобы выжить под давлением лечения.
Такая поразительная способность к изменению и захвату жизненно важных систем организма подчёркивает, насколько сложным и изобретательным противником является рак. Понимание этих механизмов — ключевой шаг к разработке более эффективных и умных стратегий борьбы с ним.
Кишечник, Иммунитет и Рак: Неожиданная Связь
В последние годы наука всё глубже проникает в удивительный мир взаимосвязей внутри нашего организма. Одно из наиболее поразительных открытий — ключевая роль взаимодействия между раком и нашим кишечным микробиомом в формировании иммунного ответа.
Представьте себе: когда пациентам с распространёнными, устойчивыми к лечению солидными опухолями проводили трансплантацию фекальной микробиоты, это значительно улучшало эффективность получаемой ими иммунотерапии. Этот факт говорит сам за себя: здоровье нашего кишечника напрямую влияет на способность иммунитета бороться с раком [47,48,49].
Иммунитет: Главный Защитник от Рака
Совокупность современных научных данных убедительно доказывает, насколько критичен наш иммунный ответ для предотвращения распространения и колонизации рака. Иммунная система — это наш внутренний страж, который постоянно патрулирует организм, выявляя и уничтожая потенциально опасные клетки.
Однако есть и обратная сторона медали. С возрастом наши иммунные клетки становятся менее "интактными" — в научном жаргоне это называется иммуностарением. Это означает, что наша продолжительность здоровой жизни становится уязвимой, поскольку ослабленный иммунитет хуже справляется с возникающими угрозами, включая рак.
Укрепление Иммунитета: Наша Задача
Именно поэтому крайне важно поддерживать нашу иммунную систему в полной силе. Когда появляется самая ранняя угроза рака, и тем более, когда он клинически диагностирован, нам просто необходимо её усилить. Это не просто рекомендация, это стратегия выживания. Поддержка иммунитета через здоровый образ жизни, правильное питание и, при необходимости, целенаправленные медицинские вмешательства — важнейший инструмент в борьбе за здоровье и долголетие. Позже мы обсудим современные подходы в иммунотерапии рака, которые сегодня являются важнейшим инструментом в арсенале борьбы с этим недугом.
Лучи Надежды и Тревожные Тенденции в Борьбе с Раком
В мире онкологии сегодня наблюдаются одновременно две противоположные тенденции: значительные успехи в борьбе с некоторыми видами рака и тревожный рост заболеваемости среди молодых людей.
Хорошие Новости: Снижение Смертности от Рака Молочной Железы
Радует то, что в мире общая смертность от рака, особенно от рака молочной железы, демонстрирует положительную динамику [51,52,53]. В Великобритании, например, масштабное исследование, охватившее более полумиллиона женщин с ранним инвазивным раком молочной железы, выявило заметное снижение смертности в период с 1993 по 2015 год [53,54,55]. Аналогичная картина наблюдается и в США: скорректированный по возрасту коэффициент смертности от рака молочной железы упал с 48 на 100 тысяч женщин в 1979 году до 27 на 100 тысяч в 2019 году [56,57,58]. Это впечатляющее снижение на 58%! Значительная часть этого успеха объясняется улучшением методов лечения, поскольку даже у женщин, не проходивших маммографию, выживаемость значительно возросла, а вклад скрининга оставался неизменным на протяжении сорока лет.
Плохие Новости: Рост Заболеваемости Среди Молодых
Однако есть и повод для серьезного беспокойства. Число новых случаев рака мире растет, и, по прогнозам, эта тенденция сохранится. Особенно тревожным является рост заболеваемости среди молодых людей, что зафиксировано в США, континентальной Европе, Великобритании и других странах. Это противоречит всему, что мы знаем о предрасположенности к раку с возрастом, вызывая глубокие вопросы.
Особенно заметен рост рака толстой кишки среди молодых. Он чаще всего проявляется на поздних стадиях и поражает нижний отдел кишечника. Это уже ведущая причина смертности от рака у мужчин до 50 лет и вторая по значимости у женщин в этой возрастной группе. Врачи сталкиваются со случаями запущенного рака толстой кишки даже у подростков и 20-летних [59,60,61].
Этот феномен требует немедленного и глубокого изучения. Что меняется в нашем образе жизни, окружающей среде или генетике, что вызывает такой рост заболеваемости у тех, кто, казалось бы, находится вне группы риска?
Рак Молодеет: Тревожные Факторы Риска
К сожалению, тенденция к увеличению числа случаев рака среди молодых людей не ограничивается раком толстой кишки. Этот рост также заметен для таких видов, как рак молочной железы, матки и мочеполовой системы, особенно в возрастной группе от 30 до 39 лет. Например, в Соединенных Штатах наблюдается рост заболеваемости по 17 из 34 типов рака в более молодых когортах, причем девять из них ранее демонстрировали снижение [62,63,64]..
Это явление вызывает серьезную озабоченность. Было бы неудивительным, если одной из основных причинстало бы высокое потребление ультра-обработанных продуктов, широкое воздействие канцерогенов из окружающей среды или чрезмерное использование антибиотиков.
Роль Ожирения и Микробиома
Статистика показывает, что почти половина молодых пациентов с диагностированным раком толстой кишки имеют избыточный вес, а 17% страдают ожирением [65,66,67]. Остается вопрос, способствуют ли избыточный вес или ожирение, а также другие упомянутые потенциальные объяснения, развитию рака у молодых людей. Это требует дальнейших исследований, но уже сейчас очевидно, что современные изменения в образе жизни играют значительную роль.
Последний упомянутый фактор — злоупотребление антибиотиками — может приводить к непреднамеренным, но серьезным изменениям в микробиоме кишечника. Эти изменения, в свою очередь, способны вызывать специфические бактериальные мутации, которые могут способствовать развитию рака.
Мы знаем, что компоненты микробиома кишечника оказывают существенное влияние на успех иммунотерапии рака. Однако, к сожалению, этот фактор не оценивается у онкологических пациентов, не говоря уже о целенаправленной модуляции микробиома с помощью пребиотиков, пробиотиков или бактериальных консорциумов (введение многих штаммов). Клинические испытания таких вмешательств уже находятся в разработке, открывая ещё одно захватывающее направление в персонализированной онкологии [203,204,205].
Грядущая Волна Рака: Насколько Мы Готовы?
Мир стоит на пороге колоссального вызова в сфере здравоохранения: по прогнозам, число новых случаев рака увеличится с 20 миллионов в 2022 году до 35 миллионов в 2050 году. Это ошеломляющий рост на 77%[68,69,70]. Вероятно нужно менять подходы в раннем предупреждении, диагностике и своевременном лечении онкологических заболеваний.
Устаревшая Классификация: Тормоз Прогресса
Привычная классификация рака по органам — это система, используемая более ста лет, — демонстрирует нашу неготовность принять научный прогресс. Она устарела. Сегодня гораздо эффективнее определять рак по его молекулярным характеристикам, зачастую независимо от того, в каком органе он впервые появился.
Благодаря секвенированию геномов десятков тысяч опухолей мы можем выявлять драйверные мутации и сопоставлять их с ответом на лечение. Это даёт нам совершенно новые, более точные способы классификации рака, которые, к сожалению, пока не стали частью рутинной медицинской практики. Такая задержка приводит к ненужным промедлениям в лечении миллионов людей, лишая их доступа к наиболее эффективным и персонализированным подходам.
Затянувшийся Путь к Спасению: Почему Инновации Запаздывают?
В мире, где научные прорывы совершаются с ошеломляющей скоростью, парадоксально медленное внедрение новых методов лечения в клиническую практику стоит жизней. Возьмем, к примеру, ниволумаб (Опдиво) — моноклональное антитело, нацеленное на белок PD-L1, который активно экспрессируется многими агрессивными опухолями. Однако пациенткам с раком молочной железы или гинекологическим раком приходилось ждать от семи до десяти лет, прежде чем это спасительное средство становилось для них доступным.
PARP-Ингибиторы: История Упущенных Возможностей
Аналогичная ситуация произошла с PARP-ингибиторами, такими как олапариб (Линпарза). Ещё в 2005 году было убедительно показано, что эти препараты эффективно уничтожают клетки с мутациями BRCA1 или BRCA2. Олапариб получил одобрение для лечения рака яичников в 2014 году, но потребовалось целых шесть лет, прежде чем он был одобрен для применения при раке молочной железы, поджелудочной железы и простаты. В результате этой недопустимой задержки, по приблизительным подсчетам, около двухсот тысяч человек, которые могли бы получить пользу от этого лечения, ушли из жизни [71,72,73].
Молекулярная Точность – Это Главное
Сегодня мы располагаем множеством мутационно-специфических методов лечения, способных точечно воздействовать на опухоль. Однако возможность их применения для пациентов слишком часто упускается. Основная причина? Мы по-прежнему застряли в устаревшей системе классификации рака по органам, вместо того чтобы ориентироваться на его молекулярные характеристики.
Часто мы упускаем шанс спасти жизнь, потому что у пациентов просто нет полной молекулярной характеристики их опухоли. Это поистине трагично, особенно в наше время, когда:
- Стоимость секвенирования генома значительно снизилась.
- Искусственный интеллект (ИИ) способен эффективно определять драйверные мутации и даже прогнозировать ответ на иммунотерапию.
Массовый Скрининг Рака: Когда "Универсальный Подход" Подводит?
Наш текущий подход к массовому скринингу рака, основанный исключительно на возрасте, далёк от совершенства. В сегодняшней практике для пяти наиболее распространённых видов рака – молочной железы, толстой кишки, лёгкого, шейки матки и простаты – возраст остается единственным критерием для определения, кому проходить обследование. Но цифры говорят сами за себя: лишь 14% случаев рака из первых четырёх упомянутых типов ежегодно выявляются именно с помощью скрининга [74,75,76].
Дорого и Неэффективно: Проблемы Текущего Подхода
Этот "универсальный" подход ежегодно обходится странам в сотни миллиардов долларов. При этом он сопровождается высоким уровнем ложноположительных результатов и бесконечными спорами о том, какой возраст считать оптимальным для начала, частоты и прекращения скрининга. Данные поражают своей отрезвляющей ясностью: лишь один человек из тысячи, прошедших скрининг в течение десяти лет, избегает смерти от конкретного вида рака [77,78,79],. Это крайне низкая эффективность.
Маммография: Спорные Результаты и Гипердиагностика
Возьмём, к примеру, маммографию для скрининга рака молочной железы. У примерно половины женщин в течение десятилетия она приводит к ложноположительным результатам, хотя 88% женщин никогда не заболеют раком молочной железы [80,81,82]. Ещё более серьёзная проблема — гипердиагностика: ненужное выявление и зачастую лечение неопасных форм рака молочной железы. Это происходит примерно у одной из трёх женщин в возрасте от 70 до 74 лет и почти у половины женщин в возрасте от 75 до 84 лет [83,84]. В целом, у каждой седьмой женщины в возрасте от 50 до 74 лет наблюдается гипердиагностика рака молочной железы.
Метаанализ рандомизированных исследований, оценивающих эффективность маммографии, колоноскопии, простат-специфического антигена (ПСА) и КТ лёгких, охвативший более 2,1 миллиона человек со средним сроком наблюдения в десять лет, не показал никакого улучшения продолжительности жизни [85,86,87].
К этим проблемам добавляется резко возросшее число молодых людей, у которых развивается рак. Часто эти случаи выявляются на поздних стадиях, поскольку они не достигли возраста, предусмотренного текущими рекомендациями по скринингу. Очевидно, что наша система требует срочного переосмысления.
Искусственный Интеллект: Ключ к Раннему Выявлению Рисков Онкологических Заболеваний?
Идея раннего выявления рака, задолго до его распространения, безусловно, верна. Однако то, что мы имеем сейчас, когда около половины всех случаев рака диагностируются на поздних, 3-й или 4-й стадиях, с уже развившимися метастазами, к сожалению, не позволит добиться значимого улучшения продолжительности здоровой жизни населения в целом.
К счастью, у нас есть все возможности для перезагрузки системы скрининга для людей без симптомов. Первый и ключевой шаг — это определение групп высокого риска. Именно это должно стать основой для тщательного наблюдения за человеком и позволит поставить максимально ранний диагноз, как только рак начнёт проявляться, задолго до того, как он станет виден на снимках МРТ или КТ.
Мультимодальный ИИ: Новый Уровень Точности
Сегодня этого можно достичь с беспрецедентной точностью, используя множественные источники данных и мультимодальный искусственный интеллект (ИИ). ИИ способен интегрировать множество слоёв информации, выходящих далеко за рамки нашей привычной клинической оценки риска, которая обычно ограничивается несколькими факторами, такими как курение, семейный анамнез или сопутствующие заболевания.
ИИ в профилактике рака включает в себя:
- Всестороннюю оценку риска с помощью мультимодального ИИ.
- Активное наблюдение за людьми из групп высокого риска.
- Раннее выявление многих видов рака (MCED).
- Агрессивные профилактические стратегии.
ИИ "Видит" Невидимое: Революция в Анализе Данных
Разделение по риску использует уникальную способность ИИ "видеть" то, что недоступно человеческому глазу, даже самому опытному специалисту. Это достигается за счёт систематической обработки содержимого электронных медицинских карт человека, которые теперь, благодаря генеративному ИИ, включают даже неструктурированный текст — а ведь именно в нём часто скрывается важнейшая информация.
Последовательные лабораторные анализы и радиологические снимки могут заново рассказать целую историю, даже если ранее они считались "нормальными". При продольной оценке ИИ способен выявить тонкие тенденции, указывающие на движение в "неправильном направлении" – предвестники заболевания, которые мы могли бы упустить. Это открывает новую эру в ранней диагностике и персонализированной профилактике рака.
Эпоха массового, «усреднённого» подхода к скринингу рака уходит в прошлое. На передний план выходят мощные инструменты — искусственный интеллект (ИИ) и генетические данные, которые кардинально меняют наше представление о ранней диагностике.
ИИ-Глаза: Видеть Невидимое на Снимках
Сотни исследований уже подтвердили невероятную мощь ИИ в повышении точности интерпретации медицинских изображений. Теперь мы можем гораздо эффективнее избегать пропуска даже мельчайших лёгочных узелков на рентгеновском снимке грудной клетки. Машинное зрение способно обнаруживать аномалии, которые даже опытные радиологи не стали бы искать, например, в поджелудочной железе при КТ грудной клетки. Это совершенно новый уровень детализации, открывающий путь к беспрецедентно раннему выявлению.
Полигенные Показатели Риска: Ваш Генетический Портрет
Вместе с ИИ на сцену выходят генетические данные, будь то в форме полигенных показателей риска (ППР)или полного секвенирования генома. ППР, который можно получить недорого с помощью генного чипа, оценивает более миллиона распространённых геномных вариантов, связанных с риском определённого вида рака. Хотя изначально эти показатели были разработаны на когортах пациентов европеоидной расы, их точность и клиническая полезность значительно возросли благодаря включению данных из разнообразных популяций с другой расовой принадлежностью [88,89,90].
Несмотря на скептицизм некоторых исследователей, призывающих к многолетним рандомизированным испытаниям для подтверждения их эффективности, многие системы здравоохранения уже начали клиническое внедрение ППР. Такие масштабные испытания вряд ли будут проведены, и даже при наличии финансирования они заняли бы слишком много времени.
Главная цель полигенного показателя риска — выявление людей с высоким риском для их тщательного наблюдения. Пусть даже некоторые пройдут излишние обследования (ложноположительный результат), это всё равно гораздо лучше, чем нынешний универсальный подход. Важно помнить, что ППР могут пропускать случаи высокого риска, поэтому критически важно использовать несколько слоёв ортогональных (дополнительных, аддитивных) данных.
Практическое Применение: Пилотные Проекты
Медицинская система Mass General Brigham в Бостоне уже внедрила предоставление полигенных показателей риска своим пациентам. Опубликованные результаты впечатляют: среди более 36 тысяч участников различного происхождения у 8,6% был выявлен высокий риск рака молочной железы, у 5,4% — рака толстой кишки, и у 13% — повышенный риск рака простаты. Все эти люди имели более чем двукратный риск по сравнению с общей популяцией [91,92,93].
Данные из Финского банка данных FinnGen, включающего более 450 тысяч человек, показали, когда следует начинать скрининг рака толстой кишки: для людей с самым высоким риском (верхний 1%) оптимальный возраст составлял 49 лет, а для людей с самым низким риском (нижние 20%) — 67 лет [94,95,96]. Это позволило бы большинству избежать множества ненужных колоноскопий! Аналогично, разделение по низкому полигенному показателю риска среди более 25 тысяч женщин в проекте Healthy Nevada показало потенциал отсрочки маммографии на 5-10 лет для тех, у кого риск снижен более чем на 60% [97,98,99]. Эти примеры демонстрируют, что персонализированный подход, основанный на генетике, не только точнее, но и экономичнее, а главное — гораздо эффективнее в спасении жизней.
Аргументы в пользу рутинного полногеномного секвенирования для определения риска рака становятся всё более убедительными. Сегодня расшифровка всех трёх миллиардов "букв" нашего генома может быть выполнена примерно за 200 долларов – сумма, которая когда-то казалась немыслимой. Мы уже более десяти лет знаем о сотнях генов предрасположенности к раку, и секвенирование способно выявить их все.
Опыт Исландии: Веские Доказательства
В Исландии был проведён уникальный эксперимент: почти 58 000 человек прошли полногеномное секвенирование, а более 108 000 — исследование с использованием генного чипа. Результаты поразительны: у 4%участников были обнаружены действенные мутации генов, вызывающие заболевания. Причём почти половина из них пришлась на мутации генов рака (таких как BRCA1, BRCA2, PALB2, MSH6, PMS2), связанные с высоким риском развития рака молочной железы, яичников, простаты, поджелудочной железы или толстой кишки [100,101,102]. Аналогичные частоты этих мутаций были выявлены и в Биобанке Великобритании, а также в других когортах [103,104,105].
Исландские данные особенно ценны, поскольку они включают информацию из свидетельств о смерти. Они наглядно демонстрируют, что носители вариантов, вызывающих рак, умирали в среднем на три года раньше. Примечательно, что даже без учёта "основательской" мутации в BRCA2, характерной для исландской популяции и связанной с сокращением продолжительности жизни на семь лет, общая картина оставалась тревожной. Как было отмечено в сопутствующей редакционной статье: "К 65 годам 10% участников с патогенными или вероятно патогенными вариантами в генах рака умерли. В отличие от этого, в группе участников без такого варианта 10% умерли к 73 годам."[106,107,108]
Важно отметить, что эти результаты были проанализированы лишь для 73 генов, которые в настоящее время Американским колледжем медицинской генетики и геномики (ACMG) признаны "пригодными для действия". Это ничтожно малая доля (всего 0,3%) от примерно двадцати тысяч генов в нашем геноме [109,110,111]. Проект Healthy Oregon, занимающийся популяционным секвенированием всего генома, включил в свои отчёты некоторые дополнительные гены рака и обнаружил, что у 5% его когорты была патогенная или вероятно патогенная мутация гена рака [112,113,114].
Экономическая Выгода и Будущее
Оценка популяционного секвенирования для трёх распространённых наследственных заболеваний — рака молочной железы и яичников, синдрома Линча и семейной гиперхолестеринемии — показала его рентабельность для людей моложе сорока лет. Это не просто вопрос передовых технологий, но и вопрос здравого смысла и экономической целесообразности. Раннее выявление рисков может значительно сократить расходы на лечение уже развившихся, метастатических форм рака.
Не пора ли нам задуматься о том, чтобы сделать полногеномное секвенирование рутинной процедурой, чтобы дать людям возможность узнать о своих рисках и принять меры задолго до того, как болезнь даст о себе знать?
Новые Биомаркеры: Прорыв в Оценке Риска Рака?
В современной медицине мы ищем новые способы прогнозирования и предотвращения рака, и биомаркерыобещают стать настоящим прорывом. Некоторые из них уже показали свою связь с повышенным риском определённых видов рака, например, специфические белки для рака поджелудочной железы или циркулирующая ДНК микробиома для рака лёгких.
Загадка Клонального Гемопоэза: Предвестник Онкологии
Одним из наиболее интригующих примеров является клональный гемопоэз неопределённого потенциала (CHIP) — состояние, при котором в стволовых клетках крови обнаруживаются клоны с частотой мутаций драйверных генов более 2%. Это явление, становящееся всё более распространённым с возрастом, можно выявить с помощью секвенирования генома. Присутствие CHIP несёт в себе одиннадцатикратный риск развития рака крови и повышенный риск рака лёгких и немеланомного рака кожи [115,116,117].
Несмотря на то что CHIP фигурирует в сотнях научных публикаций в ведущих биомедицинских журналах, он, как и многие другие потенциальные биомаркеры, до сих пор не нашёл своего рутинного применения в клинике в качестве маркера повышенного риска. Это упущенная возможность для ранней диагностики и профилактики.
Воспаление и Рак: Недооценённая Связь
Аналогично CHIP, другой важный показатель - маркеры воспаления, такие как высокочувствительный С-реактивный белок (hs-CRP), не используются для оценки риска рака, хотя данные убедительно подтверждают их значимость. Масштабное исследование, в котором изучалось моноклональное антитело, направленное против ключевого белка интерлейкина-1-beta (с целью подавления воспаления), показало значительное снижение числа смертельных случаев рака и рака лёгких. Примечательно, что это исследование было изначально разработано для уменьшения сердечно-сосудистых событий, а основным критерием включения десяти тысяч участников был именно повышенный уровень hs-CRP.
Результаты этого исследования говорят нам о том, что прямое измерение маркеров воспаления в крови и последующее направление противовоспалительного лечения имеет огромный потенциал для снижения заболеваемости раком. Это совершенно иной подход, который мы не применяем сегодня и не развиваем в полной мере с использованием лучших биомаркеров и лекарств.
"Иммуном": Новый Горизонт в Диагностике Рака
Представьте себе мир, где мы могли бы оценить иммунный статус каждого человека с помощью комплексного теста — того, что можно назвать «иммуномом». Такой глубокий анализ нашего врождённого и адаптивного иммунитета помог бы нам выявить людей с нарушенной реактивностью, что, к сожалению, часто наблюдается с возрастом.
От Диагноза к Действию: Персонализированный Подход
Выявление таких уязвимых мест в иммунной системе могло бы стать сигналом к немедленным действиям. Мы могли бы оперативно применять вакцины или другие стратегии для укрепления иммунитета у человека из группы высокого риска, не дожидаясь появления болезни. Это революционный шаг от реактивной медицины к проактивной, персонализированной профилактике.
Сегодня в рутинной практике у нас есть лишь один, довольно рудиментарный, иммунный маркер — соотношение лейкоцитов к лимфоцитам. Тем не менее, даже этот простой показатель удивительным образом предсказывает исходы при всех основных заболеваниях, включая онкологические. Представьте, насколько мощнее стала бы наша способность предсказывать и предотвращать рак, если бы мы имели доступ к полному "иммуному" профилю!
Рак Поджелудочной Железы: Новая Надежда в Борьбе с Безжалостным Убийцей
Рак поджелудочной железы — это один из самых коварных и смертоносных видов рака, известный своей поздней диагностикой и крайне высокой смертностью. Пятилетняя выживаемость при нём составляет менее 10%. Во многих развитых странах он уже вышел на третье место по причинам смертности от рака, уступая лишь раку лёгких и толстой кишки.
В свете этой тревожной статистики, учёные и врачи ищут новые подходы к ранней диагностике. Обнадеживающие результаты были получены в ходе крупного исследования, охватившего две огромные когорты пациентов: более восьми миллионов человек в Дании и около трёх миллионов в системе здравоохранения США Veterans Affairs. В общей сложности было диагностировано почти 28 тысяч случаев рака поджелудочной железы [118,119,120].
Искусственный Интеллект: Прорыв в Прогнозировании
Когда модель искусственного интеллекта (ИИ) проанализировала все электронные медицинские карты этих пациентов за несколько лет, она достигла впечатляющей точности в прогнозировании того, у кого разовьётся рак поджелудочной железы. В группе самого высокого риска, среди людей в возрасте 50 лет и старше, 320 из 1000 человек действительно заболели раком поджелудочной железы. Это впечатляющий показатель!
Аналогичное исследование, проведённое в 55 медицинских учреждениях США, подтвердило эти данные. Аналитика ИИ электронных записей смогла различить 35 000 пациентов, у которых развился рак поджелудочной железы, от 1,5 миллиона человек, у которых его не было [121,122,123]. В обоих исследованиях модель ИИ выявила десятки неочевидных признаков, которые в совокупности объясняли её высокую эффективность. Среди них были результаты лабораторных анализов, неопределённые симптомы, принимаемые лекарства и сопутствующие заболевания. Важно подчеркнуть, что эти результаты были получены исключительно на основе анализа хронологических электронных медицинских записей.
Эти прорывы показывают, что ИИ способен "видеть" скрытые особенности и характеристики в огромных массивах данных, открывая путь к радикальному изменению подхода к ранней диагностике рака поджелудочной железы.
Будущее Диагностики: Как Объединить Генетику, Изображения и Биомаркеры для Борьбы с Раком
Что, если бы мы могли добавить к анализу электронных медицинских карт ещё несколько слоёв данных, таких как секвенирование генома, медицинские изображения и биомаркеры крови? Этот комплексный подход обещает стать настоящей революцией в раннем выявлении и лечении рака.
Если бы полногеномное секвенирование стало рутинной процедурой, мы бы не пропустили данные из генов, предрасполагающих к раку поджелудочной железы с высоким риском. Речь идёт о мутациях в BRCA1, BRCA2, PALB2, CDKN2A, ATM, а также генах, связанных с синдромом Линча (MLH1, MSH2, MSH6, PMS2 и EPCAM), синдромом Пейтца-Егерса (STK11) и синдромом Ли-Фраумени (TP53). Эти знания, полученные с помощью геномики опухоли и аналитики ИИ, позволят разработать более успешный план лечения и даже предсказать рецидив опухоли более чем за десять лет до первоначального диагноза.
ИИ-Глаз на Неконтрастных Снимках: Прорыв в Диагностике
Многие пациенты проходят КТ грудной клетки или брюшной полости без контрастного вещества по самым разным причинам, не связанным с обследованием поджелудочной железы. Однако модель ИИ была обучена точно обнаруживать рак поджелудочной железы даже на таких снимках, значительно превосходя в этом радиологов. Эта задача ранее считалась настолько сложной, что её выполнение на неконтрастных сканированиях казалось невозможным. Новая работа подтвердила эту возможность, продемонстрировав способность ИИ выявлять преинвазивный рак поджелудочной железы с высокой точностью на стандартных КТ брюшной полости.
Биомаркеры: Дополнительные Индикаторы
Помимо этого, соединения углеводный антиген 19.9 (CA19-9) и билирубин уже показали свою корреляцию с раком поджелудочной железы, помогая отличать его от доброкачественных аномалий. В скором времени мы углубимся в другие слои данных, касающихся рака поджелудочной железы, чтобы предсказывать оптимальное лечение и исходы для пациентов [124,125,126].
Объединение всех этих мощных инструментов — геномики, ИИ-анализа изображений и биомаркеров — открывает беспрецедентные возможности для ранней и точной диагностики, что является ключом к успешной борьбе с этим агрессивным заболеванием.
Искусственный Интеллект и Рак Молочной Железы: Революция в Скрининге
Пришло время поговорить о том, как искусственный интеллект (ИИ) меняет подходы к борьбе с раком молочной железы. Как указывалось выше, что лишь у 12% женщин в США когда-либо разовьётся рак молочной железы в течение жизни [127,128,129]. Если бы мы могли точно определить, кто находится в группе риска, это избавило бы подавляющее большинство женщин от частых и порой травмирующих процедур скрининга, ложноположительных результатов, связанных с ними повторных обследований и биопсий, не говоря уже о тревоге и огромных расходах, которые они порождают, и проблеме гипердиагностики.
Точечный Скрининг: От "Всех Подряд" к "Тем, Кому Нужно"
Один из эффективных способов — разделение по риску на основе маммограммы, где ИИ может предоставить важную прогностическую информацию о пятилетнем риске развития рака. Это подводит нас к ещё одному ключевому моменту: просто знать, что человек находится в группе риска в течение жизни, недостаточно. Мы также хотим понимать, когда именно рак, скорее всего, проявится.
Модель анализа текстуры маммограммы, проверенная на более чем 280 000 скринингах в Нидерландах и Дании, показала впечатляющие результаты: 10% женщин с самым высоким риском развили около 40% всех случаев рака молочной железы во время последующего наблюдения [130,131,132]. Модель ИИ для маммографии, оценённая в европейском исследовании «случай-контроль» (case-control) с участием четырёх стран, смогла выявить женщин с высоким риском, которым ранее сообщали, что их маммограмма была нормальной.
ИИ Превосходит Традиционные Методы
В многоцентровом исследовании, охватившем четыре центра в трёх странах — США (Mass General и Emory), Швеции (Каролинска) и Тайване (Chang Gung) — ИИ-модель для маммографии, предсказывающая будущий риск, оказалась значительно более эффективной, чем рутинный, основанный на возрасте скрининг. Её преимущества заключались как в сокращении числа ненужных маммограмм, так и в более раннем обнаружении реальных случаев рака [133,134,135].
Эти результаты убедительно демонстрируют, что ИИ не просто дополняет, а радикально трансформирует наш подход к скринингу рака молочной железы, делая его более точным, персонализированным и, в конечном итоге, спасающим жизни.
От Одной Маммограммы к Комплексному Портрету Риска: Будущее Скрининга Рака
Привязка оценки риска рака молочной железы только к маммограмме — или, в некоторых случаях, к УЗИ или МРТ — это лишь одно измерение, словно мы смотрим на картину сквозь замочную скважину. Чтобы получить полную картину, необходимо добавить другие, многослойные данные.
Будущее скрининга лежит в мультимодальном подходе, который будет интегрировать в себе:
- Факторы образа жизни: Ожирение, потребление алкоголя, уровень физической активности — всё это играет значимую роль.
- Полигенный показатель риска: Генетический профиль, который может указывать на предрасположенность к определённым видам рака.
- Полное секвенирование генома: Детальный анализ нашей ДНК, выявляющий специфические мутации.
- Репродуктивные факторы: Возраст менархе (первой менструации), возраст менопаузы, количество беременностей и родов, возраст первых родов, а также грудное вскармливание — все эти аспекты влияют на риск.
Хотя такая комплексная мультимодальная модель ещё не прошла проспективную оценку, ожидается, что она позволит точно разделить людей на группы низкого, среднего и высокого риска. Это кардинально изменит подход к скринингу, заменив нынешний массовый скрининг, основанный только на возрасте. Вместо универсального подхода, мы перейдем к персонализированному скринингу, ориентированному на индивидуальные риски. Многие проспективные клинические испытания индивидуализированного скрининга уже находятся в разработке, предвещая новую эру в ранней диагностике рака
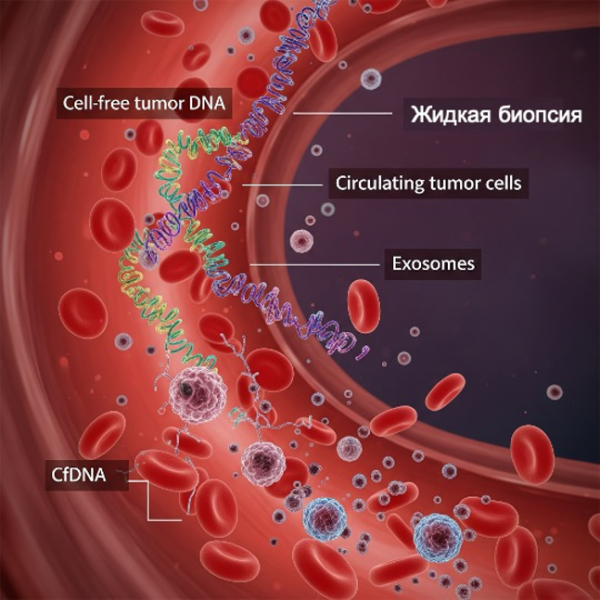
"Жидкая Биопсия": В Поисках Микроскопических Признаков Рака
Помимо многослойного анализа данных, который помогает выявить группы высокого риска, огромный интерес вызывают тесты, способные напрямую обнаружить микроскопические признаки рака в организме человека. Часто их называют "жидкой биопсией", хотя этот термин не всегда точно отражает суть.
Анализы Раннего Выявления Многих Видов Рака (MCED): Новые Горизонты
Различные тесты ищут тончайшие "отпечатки" рака [136,137,138], такие как:
- Бесклеточная опухолевая ДНК (боДНК) в плазме крови.
- Фрагментация опухолевой ДНК и её метилирование.
- Циркулирующие опухолевые клетки в крови.
- Циркулирующие экзосомы, белки, метаболиты.
- Бесклеточная опухолевая ДНК в моче или кале.
- РНК-тесты без клеток, повторяющиеся элементы ДНК.
- Изменения Т-клеточных рецепторов.
Эти анализы раннего выявления многих видов рака (MCED) постоянно совершенствуются. Например, хотя количество бесклеточной опухолевой ДНК в образце крови может быть крайне ограниченным, добавление праймирующих агентов позволяет уменьшить её клиренс (выведение из организма) и значительно повысить точность тестирования [139,140,141].
ИИ и Сверхчувствительность: Заглядывая в Будущее Диагностики
Более того, глубокое обучение ИИ способно преодолевать проблему низкого количества, радикально обогащая соотношение сигнала к шуму. Это делает такие анализы сверхчувствительными, позволяя обнаружить даже самые минимальные признаки болезни.
Один из самых сложных для ранней диагностики видов рака — рак яичников, но уже показано, что ИИ-анализ маркеров метилирования ДНК значительно улучшает текущую оценку риска этого заболевания. Существуют также анализы, которые обнаруживают определённые белки или метаболические маркеры, например, гликозаминогликаны, указывающие на повышенную вероятность присутствия рака. Разрабатываются и комплексные анализы крови, объединяющие ДНК и белки в единые панели [142,143,144].
Все эти инновации приближают нас к тому дню, когда рак будет обнаружен на самой ранней стадии, предоставляя врачам и пациентам критически важное время для эффективного лечения.
Тест Galleri: Прорыв или Иллюзия Ранней Диагностики?
На сегодняшний день одним из самых обсуждаемых и широко используемых в клинической практике тестов для раннего выявления рака является GRAIL Galleri. Этот анализ крови исследует метилирование ДНК на сотнях тысяч участков, связанных с раком, используя технологию бисульфитного секвенирования. Затем искусственный интеллект (ИИ) определяет наличие "ракового сигнала" и, если он обнаружен, помогает установить вероятный орган-источник [145,146,147].
Первые Результаты: Надежды и Опасения
В масштабном проспективном клиническом исследовании с участием более 6600 человек в возрасте 50 лет и старше (92% из которых были белыми) раковый сигнал был обнаружен у 92 участников (1,4%). Из них у 35 человек (0,5%) рак действительно был подтвержден после дополнительного обследования. Это даёт положительную прогностическую ценность всего 38%. Точность ИИ в определении предполагаемого органа происхождения рака оказалась значительно выше — 97%, что впечатляет, учитывая разнообразие возможных локализаций, включая кости, голову и шею, яичники, печень, матку, кровь, молочную железу, легкие и желудочно-кишечный тракт.
Однако есть существенный нюанс: большинство выявленных случаев рака (57%) были на стадии 3 или 4, то есть уже метастатическими. Это означает, что тест пока не является панацеей для ультраранней диагностики. При этом 57 человек получили ложноположительный раковый сигнал, что указывает на высокую специфичность теста — 98%, то есть низкую частоту ложноположительных результатов. Интересно, что аномальный сигнал метилирования бесклеточной ДНК у некоторых людей может отражать временное появление микроскопического рака, который был успешно подавлен иммунной системой организма. Единичные случаи, когда у людей был ложноположительный результат, а при повторном тестировании он становился отрицательным, предполагают необходимость более длительного наблюдения для оценки распространённости этого явления. Возможно, укрепление нашей иммунной системы может стать действенной профилактической стратегией, которую стоит применять [148,149].
Эффективность и Ограничения: Неизвестные Факторы
Главная проблема этого теста, который продаётся по цене около 1000 долларов для людей в возрасте 50 лет и старше, заключается в его удивительно низкой эффективности в выявлении рака на ранних стадиях. Только пять из тысячи человек дают положительный результат, и из них лишь два из тысячи фактически были диагностированы на ранней стадии (стадии 1 или 2), до того, как рак распространился. Доля ложноотрицательных результатов среди каждой тысячи протестированных людей остается неизвестной. И, к сожалению, любой, кто получает отчёт «раковый сигнал не обнаружен», не должен быть абсолютно уверен в отсутствии у него развивающегося рака.
Galleri, безусловно, представляет собой значительный шаг вперёд в области ранней диагностики, но его текущие ограничения требуют осторожного подхода и дальнейших исследований. Он подчёркивает, что путь к по-настоящему универсальной и эффективной "жидкой биопсии" ещё долог.
Ситуации, Когда Ищем Прорыв, но Столкнулись с Препятствиями
Сегодня показатель выявления рака на ранних стадиях (1-й и 2-й) остаётся удручающе низким по сравнению с поздними. А ведь обнаружение опухоли, пока она ещё микроскопическая, невидима на снимках, не вызывает симптомов и не начала распространяться, — это ключ к изменению траектории развития болезни и улучшению результатов лечения. Проще говоря, обнаружение не всегда равносильно спасению жизни.
Рандомизированные Испытания: Необходимость и Вызовы
Именно поэтому так важны масштабные рандомизированные исследования, подобные тем, что проводят Национальная служба здравоохранения Великобритании (с участием 140 000 человек) и Национальный институт рака США (с 225 000 участников) [150,151,152]. Эти колоссальные испытания, включающие здоровых, бессимптомных людей, вновь используют возраст в качестве основного критерия отбора. Потребуются годы, прежде чем такие исследования будут завершены и дадут оценку клинических результатов. При этом неизбежно возникнут вопросы о разнообразии участников, ведь мы знаем, что возникновение и поведение многих видов рака тесно связаны с происхождением человека.
Однако отсутствие убедительных доказательств из рандомизированных исследований, возможно, не самая большая проблема. Гораздо важнее, что ни один из этих тестов на раннее выявление рака пока не одобрен FDA(Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США) и, соответственно, не возмещается страховыми компаниями. Это серьёзное препятствие на пути их широкого внедрения.
Путь к Персонализации и Доступности
К сожалению, на сегодняшний день эти перспективные тесты следуют шаблону массового скрининга, используя лишь возраст, вместо того чтобы интегрировать все данные человека для определения его индивидуального риска. Существует огромный потенциал для комбинирования тестов (например, секвенирования и метилирования бесклеточной опухолевой ДНК) для повышения точности, но это, безусловно, увеличит стоимость. Впрочем, есть и обнадёживающие примеры: одна компания, использующая метод фрагментации ДНК, уже включила полигенные показатели риска в свою оценку без дополнительных затрат, что является важным шагом в правильном направлении [153,154].
Будущее — за персонализированным подходом, который не только значительно повысит эффективность ранней диагностики, но и сделает её более доступной и экономичной. Но пока нам предстоит преодолеть множество барьеров на пути к этой цели.
Полное МРТ: Маркетинговая Шумиха или Спасение?
На фоне стремительного развития высокотехнологичных методов диагностики рака, таких как "жидкие биопсии", активно продвигается использование комплексных МРТ-исследований всего тела. Однако, несмотря на агрессивный маркетинг, эффективность этого метода вызывает серьёзные вопросы. В отличие от микротестов, способных теоретически обнаружить рак на самой ранней, микроскопической стадии, МРТ может выявить опухоль только тогда, когда она достигает определённого размера. Это макроскопический метод, и он гораздо реже обнаруживает рак на ранней стадии, чем исследованные нами микротесты.
Каскад Тревог: Ложные Срабатывания и Последствия
Как и в случае с ложноположительным "раковым сигналом" от теста Galleri, аномальный результат МРТ запускает целый каскад дополнительных обследований, направленных на подтверждение или исключение рака. Этот процесс может завершиться инвазивной биопсией органа, сопряжённой с определёнными рисками. Вероятность того, что аномальная МРТ приведёт к обнаружению "инциденталом" — доброкачественных находок, таких как незлокачественный узелок или киста — очень высока. Метаанализ всех исследований показывает, что это происходит как минимум у 19% людей. Именно по этой причине, а также из-за отсутствия достаточных доказательств пользы [155,156,157], Американский колледж радиологии не рекомендует полнотелые МРТ всего тела.
Ярким примером может служить случай одного пациента, который прошёл комплексное МРТ всего тела. У него было обнаружено поражение простаты, что повлекло за собой анализы крови, специализированное МРТ простаты, а теперь и тщательное наблюдение с серийными изображениями и, возможно, будущими биопсиями. Его лечащий врач выразился очень точно: "Те, кто рекомендовал вам этот метод , вероятно, рассматривают вашу историю как успех — я рассматриваю вашу историю как трагедию. Они создали в вашем сознании эту неопределённость. Вы были здоровым человеком, а теперь вы стали пациентом".
Баланс Пользы и Вреда: Ждём Доказательств
Безусловно, как микро-, так и макротесты, включая МРТ всего тела, могут спасать жизни, обнаруживая рак у некоторых здоровых людей и приводя к своевременному лечению. Однако, существует ли чистая польза или вред от их рутинного использования в каждом конкретном случае и в популяции в целом? Мы пока не знаем. И не узнаем, пока рандомизированные испытания не оценят клинические результаты.
К счастью, для микротестов такие рандомизированные испытания уже начались, что поможет заполнить пробелы в доказательной базе. Менее полезно то, что компания Prenuvo, продвигающая МРТ всего тела, запустила лишь обсервационное исследование ста тысяч человек, проходящих такое обследование в течение следующих десяти лет [158,159,160]. Пока эти пробелы устраняются, мы знаем, что использование глубокого обучения ИИ для интерпретации многих медицинских снимков и патологических слайдов обеспечивает более точные диагнозы. В области медицинских изображений наиболее изучены и доказаны ИИ-решения для маммографии и колоноскопии.
Важно помнить: инновации должны быть подкреплены надёжными научными доказательствами, чтобы избежать ненужной тревоги и медицинских вмешательств.
Применение Искусственного Интеллекта: Революция в Диагностике Рака
Искусственный интеллект продолжает переписывать правила игры в медицине, и одним из самых ярких примеров его триумфа является область диагностики рака молочной железы. Крупнейшее рандомизированное исследование в сфере медицинского ИИ, проведённое в Швеции, наглядно продемонстрировало его потенциал.
Шведский Эксперимент: ИИ Увеличивает Выявление Рака и Снижает Нагрузку
В этом масштабном исследовании, охватившем 80 000 женщин, оценивалась интерпретация маммограмм радиологами — как с использованием ИИ, так и без него. Результаты оказались поразительными: применение ИИ увеличило количество выявленных случаев рака на 15%, при этом сократив рабочую нагрузку на 44%. Это означает, что ИИ не просто улучшает точность, но и значительно оптимизирует процесс, освобождая ценное время специалистов [161,162,163].
Дания и Венгрия Подтверждают: ИИ — Эффективный Инструмент
Аналогичные результаты были получены в Дании, где среди 60 000 женщин, прошедших маммографию до и после внедрения ИИ, наблюдалось улучшение выявления рака и уменьшение количества ложноположительных результатов. Рабочая нагрузка радиолога при этом сократилась на треть. Другие крупные проспективные исследования показали сопоставимые результаты, подтверждая эффективность ИИ в реальной клинической практике. Это было успешно воспроизведено даже в Венгрии, где комбинация ИИ и радиологов привела к 13-процентному увеличению числа диагностированных случаев рака молочной железы [164,165,166].
ИИ в США: Одобрение и Инновации
В Соединённых Штатах уже более двух десятков алгоритмов ИИ получили одобрение или разрешение FDA для обнаружения рака молочной железы. Один из таких примеров — алгоритм RadNet, который сравнил интерпретацию маммограмм только радиологом с интерпретацией радиолога в сочетании с их ИИ-системой (включающей 3D-реконструкцию). Результаты показали увеличение скорости обнаружения рака на 14%[167,168,169].
Эти данные убедительно доказывают: ИИ не просто перспективная технология, это уже реальный инструмент, который делает диагностику рака молочной железы более точной, эффективной и менее обременительной для врачей, что в конечном итоге спасает жизни.
ИИ в Маммографии: Большой Вопрос о Главном Результате
Мы уже знаем, что искусственный интеллект (ИИ) значительно увеличивает выявление рака молочной железы и снижает нагрузку на радиологов. Это бесспорный факт. Но существует один большой, пока ещё неразрешённый вопрос: изменит ли это увеличение выявления фактические результаты для людей, которым поставлен диагноз?
Иными словами, приведёт ли более раннее и частое обнаружение рака с помощью ИИ к реальному улучшению выживаемости и качества жизни? Ответ на этот важнейший вопрос должно дать масштабное шведское многолетнее рандомизированное исследование, проводимое в нестоящее время. Оно призвано прояснить истинное значение такого раннего выявления для профилактики рака молочной железы и, в конечном итоге, для здоровья миллионов женщин.
Искусственный Интеллект и Колоноскопия: Новая Эра в Выявлении Рака Кишечника
Искусственный интеллект (ИИ) продолжает революционизировать медицинскую диагностику, и область колоноскопии не стала исключением. Более тридцати трёх рандомизированных исследований сравнивали работу гастроэнтерологов, использующих традиционные методы, с работой тех, кто применял машинное зрение в реальном времени для выявления аденоматозных полипов — предвестников рака толстой или прямой кишки. Результат оказался ошеломляющим и однозначным: использование ИИ снизило пропуск полипов более чем на 50% [170,171,172]. Это значительный прорыв в раннем обнаружении потенциально опасных образований.
Однако, как и в случае с маммографией, важно помнить: диагностика полипов — это не то же самое, что изменение естественного хода развития рака толстой кишки. Следующий шаг, который предстоит доказать, — это влияние такого раннего и точного выявления на общую выживаемость и снижение смертности от колоректального рака.
Расширение Горизонтов: ИИ в Диагностике Различных Видов Рака
Принципы, доказавшие свою эффективность в визуализации рака молочной железы и толстой кишки, распространяются и на многие другие органы. ИИ уже активно применяется или демонстрирует огромный потенциал в таких областях, как:
- Выявление узлов в лёгких на рентгеновских снимках грудной клетки или КТ, которые могут оказаться злокачественными.
- Интерпретация МРТ или УЗИ простаты для диагностики рака предстательной железы.
- Диагностика вероятного рака почки по КТ брюшной полости.
- Выявление рака поджелудочной железы по КТ брюшной полости или грудной клетки.
Для всех этих методов визуализации рака результаты применения ИИ очень обнадеживают в плане повышения точности обнаружения рака. Это открывает новую эру в диагностике, приближая нас к тому моменту, когда рак будет выявляться на самых ранних стадиях, давая пациентам наилучшие шансы на успешное лечение.
ИИ-Глаз Видит Невидимое: Новые Возможности Диагностики
Искусственный интеллект стремительно проникает во все сферы биомедицины, и его влияние на патологию — область, критически важную для диагностики рака, — поистине впечатляет. Традиционно, патологи вручную оценивают окрашенные гематоксилином и эозином образцы тканей, определяя наличие рака, его доброкачественность или злокачественность, а также тип опухоли и её орган происхождения. Этот субъективный подход, к сожалению, часто приводит к значительным расхождениям в заключениях разных специалистов и ограничивает объём информации, который можно получить.
Однако прогресс, достигнутый благодаря ИИ в интерпретации гистопатологических слайдов, меняет всё. Глубокие нейронные сети ИИ способны с высокой точностью:
- Идентифицировать драйверные геномные мутации, которые определяют рост и развитие опухоли.
- Определять место происхождения даже самых сложных опухолей.
- Формулировать прогноз заболевания.
- Предсказывать ответ на лекарства, что критически важно для выбора эффективной терапии.
- Давать рекомендации по лечению в беспрецедентных масштабах.
Точность и применение ИИ расширились по всему спектру типов рака — как по органам, так и по молекулярным характеристикам. Это стало возможным благодаря мультимодальному ИИ и новому генеративному ИИ(большим языковым моделям), которые теперь могут включать данные из одноядерного секвенирования, пространственных "омиксов", микроокружения опухоли, состояния старения клеток и иммунного ответа.
Эра Интегрированных Данных: ИИ-Патолог Будущего
Такое богатое изобилие информации, абсолютно неразличимое для экспертного человеческого глаза, но "видимое" машинным зрением, изменило то, как должны оцениваться патологические образцы. Как недавно метко заметили патологи Али Башашати и С. Ларри Голденберг из Университета Британской Колумбии: «ИИ не заменит патологов, он заменит только тех, кто не использует ИИ в своей повседневной практике»[173,174,175].
Это не угроза, а призыв к эволюции. Патологи, вооружённые ИИ, смогут работать быстрее, точнее и эффективнее, предоставляя пациентам наилучшие шансы на своевременное и персонализированное лечение.
Лечение для Долгой и Здоровой Жизни: Прогресс в Онкологии
Мы уже выяснили, как можно радикально перестроить подходы к скринингу и диагностике рака, используя новые технологии. Те же принципы — точность и персонализация — применимы и к пересмотру методов лечения. Десятилетиями мы во многом полагались на токсичную химиотерапию, которая неспецифически уничтожает быстро делящиеся клетки нашего организма, вызывая мучительные побочные эффекты: расстройства пищеварения, облысение, так называемый "химический мозг". Эти методы лечения настолько мутагенны, что порой могут даже спровоцировать новый рак. К счастью, мы стоим на пороге эры гораздо более интеллектуальных, целенаправленных подходов к подавлению рака, которые сохраняют наши здоровые клетки и ткани.
Молекулярная Характеристика: Ключ к Персонализированному Лечению
Повторюсь: молекулярная характеристика рака человека жизненно важна. Многие мутации в ДНК опухоли указывают на конкретные, уже одобренные методы лечения. Гены кодируют белки, и некоторые из этих белков являются факторами роста, играющими критическую роль в развитии рака.
Среди генов с важными мутациями, способствующими предрасположенности к раку, можно выделить: HER2, BRCA1, BRCA2, EGFR, NTRK, ALK, BRAF, ERBB2, FGF, KIT, MET, RET, ROS, PIK3CA, PDGF, PD-L1 и многие другие. Даже KRAS, частая драйверная мутация, встречающаяся при раке желудочно-кишечного тракта и других видов, когда-то считалась неизлечимой. Но сегодня существуют одобренные FDA методы лечения, которые оказываются весьма эффективными [176,177,178]. Появляются и другие инновационные подходы, включая, возможно, так называемые молекулярные клеи, открывающие совершенно новые перспективы в таргетной терапии.
Эти достижения знаменуют собой переход от "ковровых бомбардировок" химиотерапией к точечным ударам по уязвимым местам раковых клеток, обещая значительно улучшить результаты лечения и качество жизни пациентов.
Таргетная Терапия: Доказанный Подход в Борьбе с Раком
Мы стоим на пороге революционных изменений в лечении рака. Токсичная химиотерапия постепенно уступает место таргетным (целенаправленным) подходам, которые дают пациентам гораздо больше надежды.
Прорыв при Раке Легких: Пример Lorlatinib
Возьмём, к примеру, пациентов с распространённым немелкоклеточным раком легкого, у которых выявлена мутация ALK. За счет традиционной терапии, их пятилетняя выживаемость составляла всего 8%. Однако с появлением лоратиниба — препарата, нацеленного непосредственно на гены ALK и ROS1, — этот показатель вырос до впечатляющих 60% [179,180,181]. Это колоссальный скачок, который наглядно демонстрирует мощь персонализированного подхода.
Помимо специфических мутаций, анализ геномной последовательности на наличие таких важных маркеров, как микросателлитная нестабильность, дефицит репарации неспаренных оснований, дефицит гомологичной рекомбинации и опухолевая мутационная нагрузка, даёт нам бесценную информацию для использования индивидуальных препаратов. Некоторые из этих таргетных лекарств доказали свою способность уменьшать или даже устранять опухоли. Однако, к сожалению, пока не всегда это приводит к существенному улучшению общей выживаемости при раке.
Победа над HER2-low Раком Молочной Железы
Напротив, мутационно-направленное лечение достигло значительных успехов при распространённом раке молочной железы у женщин с опухолями «HER2-low». Это важно, поскольку раньше рак молочной железы делили на HER2-позитивный (около 17% случаев, с уже существующими эффективными методами лечения) и остальные. HER2-low рак (около 55% пациентов). Однако сложность возникает, когда уровень фактора роста HER2 слишком низок для классификации как HER2-позитивный, и это долгое время было сложной головоломкой для врачей.
Между тем, рандомизированное исследование препарата трастузумаб дерукстекан (T-Dxd) в сравнении с ненаправленной терапией, проведённое среди более чем 550 пациентов с HER2-low раком, которые не отвечали на предыдущее лечение, привело к значительному улучшению выживаемости и выживаемости без прогрессирования [182,183,184]. Это действительно примечательно, ведь наблюдалось увеличение выживаемости в среднем на семь месяцев. Для пациентов с таким диагнозом, где ранее ожидалось лишь несколько недель жизни или полное отсутствие пользы от лечения, это огромный прорыв.
Эти успехи подтверждают, что глубокое понимание молекулярных особенностей каждой опухоли и разработка, а также правильное применение таргетных препаратов — это путь к реальному продлению и улучшению жизни пациентов.
«Вооруженные Антитела»: Революция в Лечении Рака
Мы на пороге новой эры в онкологии, где на смену традиционным, изнуряющим методам приходят высокоточные «умные бомбы». Одним из таких прототипов является T-Dxd (трастузумаб дерукстекан) — яркий пример антитела-лекарственного конъюгата. По сути, это лекарство Герцептин против рака молочной железы, к которому «привязан» химиотерапевтический препарат. Такая конструкция позволяет химиотерапии достигать высокой концентрации непосредственно в опухоли, при этом минимизируя её высвобождение по всему организму. Результат? Повышенная эффективность при значительном уменьшении побочных эффектов.
Как Работают «Биологические Ракеты»?
Как же достигается такой замечательный успех? Секрет в том, что эти препараты являются конъюгированными (соединёнными из двух молекул) антителами. Они используют компонент иммунотерапии (например, трастузумаб) для прикрепления к раковой клетке. Затем, как курьер, доставляют химиотерапевтический препарат (дерукстекан) прямо внутрь клетки, чтобы уничтожить её.
Эти «вооруженные антитела» демонстрируют беспрецедентный успех в борьбе со сложными типами опухолей. Примеры включают использование ведотина для рака мочевого пузыря или тебентафусптебна для злокачественной меланомы, а также EGFR-HER3 для нескольких распространённых солидных опухолей. Более двадцати таких «биологических ракет» уже получили одобрение FDA, и множество других находятся на разных стадиях клинических испытаний [185,186,187].
Новые Цели и Риски
Даже такие сложные цели, как белок опухоли P53 (TP53) — наиболее распространённая драйверная мутация рака, ранее считавшаяся «неизлечимой» — могут стать доступны для конъюгатной стратегии. Антитело-лекарственный конъюгат, нацеленный на маркер стволовых клеток крови, обещает стать захватывающим новым подходом к лечению рака крови и аутоиммунных заболеваний. Важно отметить, что этот класс лекарств связан с некоторыми уникальными токсическими эффектами на лёгкие, глаза и кожу, которые требуют тщательного мониторинга [188,189,190].
Иммунотерапия: Как Мы Снимаем «Тормоза» с Иммунитета для Борьбы с Раком
В основе современных подходов к лечению рака лежат иммунотерапии, которые задействуют самую мощную защитную систему нашего организма — наш собственный иммунитет. Они работают, активируя нашу иммунную систему для борьбы с раком, по сути, снимая «тормоза» с активации Т-клеток. Это критически важный процесс, который, к сожалению, часто подавляется раковыми клетками.
Активация Т-клеток: Многоступенчатая Защита
Представьте себе, что Т-клетки — это солдаты нашей иммунной системы. Активация Т-клеток — это многоступенчатый процесс защиты организма:
- Обнаружение захватчиков: Т-клетки идентифицируют чужеродные или аномальные клетки, такие как раковые.
- Вызов подкрепления: Молекулярный сигнал запускает увеличение количества Т-клеток.
- Размножение и дифференциация: Т-клетки размножаются миллионами и превращаются в другие типы иммунных клеток, готовых устранить угрозу.
- Уничтожение: Т-клетки и их вспомогательные клетки затем высвобождают особые белки, называемые цитокинами, которые способны убивать раковые клетки.
Ингибиторы Контрольных Точек: Разблокировка Иммунитета
Основой наших иммунотерапий, направленных на рак, являются ингибиторы контрольных точек. Эти препараты блокируют определённые части нашей иммунной системы, которые обычно ограничивают ответ Т-клеток. Таким образом, они приводят к более сильной, неограниченной активации Т-клеток, позволяя им атаковать рак с новой силой.
Список этих мощных ингибиторов контрольных точек включает:
- Пембролизумаб (Кейтруда), ниволумаб (Опдиво) и цемиплимаб (Либтайо), которые нацелены на белок запрограммированной клеточной смерти 1 (PD-1).
- Атезолизумаб (Тецентрик), дурвалумаб (Имфинзи) и авелумаб (Бавенсио), которые нацелены на лиганд запрограммированной клеточной смерти 1 (PD-L1).
- Препараты, такие как Кейтруда, Опдиво и Локторзи, которые блокируют взаимодействие между PD-1 и PD-L1.
- Ипилимумаб (Йервой), который блокирует CTLA-4.
- Опдуалаг (ингибитор контрольной точки LAG-3, ре-талимаб-рмбв), используемый в комбинации с ниволумабом.
Впечатляющие, Но Редкие Успехи
Одно исследование блокады PD-1 при распространённом колоректальном раке заслуживает особого внимания: все пациенты из небольшой группы с мутациями в генах, которые корректируют ошибки репликации ДНК (известные как дефицит репарации неспаренных оснований), имели выраженный клинический ответ без обнаружения опухоли при последующей визуализации. Однако, к сожалению, этот результат является скорее исключением, чем правилом. Большинство вмешательств с использованием ингибиторов контрольных точек приносят лишь краткосрочный успех.
Несмотря на эти ограничения, ингибиторы контрольных точек продолжают оставаться одним из самых перспективных направлений в онкологии, открывая путь к более эффективным и менее токсичным методам лечения.
BiTEs: Перенаправление Иммунных Клеток
Помимо уже известных ингибиторов контрольных точек и антител-лекарственных конъюгатов, появляются новые, ещё более точные и мощные инструменты иммунотерапии.
Среди них — биспецифические Т-клеточные энгаджеры (BiTEs). Эти антитела, подобно конъюгатам, имеют специальный "линкер", который напрямую связывает распознавание опухоли с Т-клетками. Это значительно усиливает иммунный ответ и уничтожение раковых клеток. Несколько BiTEs уже получили одобрение для лечения рака крови, и многие другие находятся на различных стадиях клинических испытаний [191,192,193].
Онколитические Вирусы: «Разогрев» Опухоли
Ещё одно перспективное направление — модифицированные онколитические вирусы. Эти вирусы способны инфицировать опухоль, тем самым иммунологически изменяя её с «холодной» на «горячую», активируя мощные воспалительные реакции. Такой подход может применяться как самостоятельно, так и в комбинации с ингибиторами контрольных точек. Хотя их успех был неоднозначным, недавние сообщения о раке мочевого пузыря и других устойчивых к лечению опухолях выглядят весьма многообещающими [194,195,196].
Конъюгаты Клеток и Лекарств: Следующий Шаг в Таргетной Доставке
Инновации не ограничиваются описанными ранее антителами-лекарственными конъюгатами. Развиваются и конъюгаты клеток и лекарств, где химиотерапевтические или иммунотерапевтические препараты, такие как интерлейкин-15 или интерлейкин-2, могут быть присоединены непосредственно к Т-клеткам, эритроцитам и тромбоцитам. Эти подходы тестируются в клинических испытаниях для различных видов рака [197,198,199].
Становится очевидным, что наши текущие подходы к иммунотерапии рака помогают, но слишком часто их недостаточно для достижения длительного успеха. Поэтому учёные ищут способы усилить их. Так, добавление ингибиторов Янус-киназ (JAKs) в сочетании с ингибиторами контрольных точек привело к увеличению успеха в борьбе с рефрактерной лимфомой Ходжкина и немелкоклеточным раком лёгкого. Механизм этого эффекта, похоже, заключается в блокировании иммуносупрессивного эффекта интерферонов, выделяемых Т-клетками, что восстанавливает их способность убивать раковые клетки [200,201,202].
Вакцины и Модифицированные Клетки: Будущее Иммунотерапии Рака
Наши успехи в иммунотерапии рака открывают двери для двух новых, невероятно перспективных платформ: вакцин и модифицированных клеток. Обе эти стратегии направлены на усиление нашей собственной иммунной системы, чтобы она могла эффективнее бороться с раком.
Противораковые Вакцины: Обучение Иммунитета
Противораковые вакцины, будь то на основе ДНК, мРНК или пептидов, упакованные в наночастицы или вводимые напрямую, используются для индукции мощного иммунного ответа. Цель проста: с помощью повторных инъекций обучить иммунную систему человека распознавать опухолевые клетки и безжалостно их уничтожать.
Эти вакцины создаются против уникальных белков на поверхности раковых клеток, известных как неоантигены, или нацеливаются на часто мутировавшие варианты драйверных генов, таких как KRAS или TP53. Процесс создания этих индивидуальных вакцин, часто называемый «вакциной по требованию», поистине увлекателен[206,207,208]. Элизабет Салливан, руководитель операций программы персонализированных вакцин в Moderna, так описывает это:
"Каждый бокс содержит свою собственную «одноразовую персонализированную РНК+» машину, устройство размером с холодильник, которое производит длинные нити мРНК, кодирующие до тридцати четырех специфических мутаций рака. Мутации соответствуют различным неоантигенам, аккуратно расположенным в последовательности. Затем смешивающее устройство инкапсулирует мРНК в жировые наночастицы для повышения её стабильности и клеточного поглощения."[209,210,211]
И, конечно, искусственный интеллект здесь играет ключевую роль, помогая определить, какие мутации подходят конкретному человеку для создания максимально эффективной вакцины.
Обнадёживающие Результаты: От Меланомы до Рака Поджелудочной Железы
Персонализированная мРНК-вакцина мРНК-4157, поставляемая в мРНК-наночастичной упаковке (аналогично вакцинам против COVID-19), в рандомизированном исследовании оказалась более эффективной в комбинации с пембролизумабом, чем только пембролизумаб, в борьбе с меланомой.
Ещё более впечатляющие результаты получены в трёхлетнем наблюдении за мРНК-наночастичной вакциной против рака поджелудочной железы. Эта вакцина была персонализирована с использованием антигенов, обнаруженных в удалённой опухоли, и показала стойко повышенный иммунный ответ и значительную задержку рецидива [212,213,214]. Аналогичный подход используется у пациентов с немелкоклеточным раком лёгкого, где целью является стимуляция дендритных клеток — особого типа иммунных клеток. Идея «омоложения» старых дендритных клеток иммунной системы для уничтожения опухолей у пожилых мышей наводит на мысль о тестировании такого подхода и у людей с раком. Масштабы исследований впечатляют: обширное количество РНК-вакцин находится в текущих клинических испытаниях почти для всех типов солидных опухолей. Это открывает новую главу в борьбе с раком, предлагая персонализированные и мощные инструменты для активации нашего собственного иммунитета [215,216,217].
CAR-T-Терапия и Инженерные Клетки: Революция в Борьбе с Раком
Результаты последних исследований убедительно показывают, что у медиков есть колоссальные возможности для усиления иммунного ответа на рак, используя комбинации подходов. Одним из наиболее многообещающих направлений, привлекающих значительное внимание, является инженерия Т-клеток, известная как CAR-T-терапия (химерные антигенные рецепторы – CAR-T-клетки).
CAR-T: Прорыв в Лечении Рака Крови
Это клеточная терапия рака, которая уже получила несколько одобрений FDA для различных видов рака крови. Только в США ею было успешно пролечено более 40 тысяч пациентов. Однако с солидными опухолями, составляющими подавляющее большинство случаев рака, ситуация пока сложнее, но и здесь достигается значительный прогресс [218,219,220].
Терапия CAR-T — это квинтэссенция индивидуализированного медицинского вмешательства. Она включает в себя несколько этапов:
- Извлечение Т-клеток у пациента с раком.
- Секвенирование ДНК и РНК этих клеток.
- Использование полученной информации для специфической активации Т-клеток против уникальных характеристик рака конкретного человека.
- Повторное введение модифицированных клеток пациенту.
Наряду с использованием персонализированных вакцин против неоантигенов, данный подход представляет собой вершину индивидуализированной медицины. У первых пациентов, которым CAR-T-клетки вводили непосредственно в мозг для лечения рецидивирующей глиобластомы (одного из самых смертоносных видов рака), наблюдалась быстрая и драматическая регрессия опухолей. Подобный впечатляющий ответ опухолей головного мозга был также замечен при внутривенном введении мРНК с липидными наночастицами[221,222,223].
Расширение Арсенала Иммунотерапии
Удивительно видеть, как развиваются инженерные Т-клетки и противораковые вакцины. Они значительно расширили наш арсенал средств для усиления иммунного ответа человека на рак. Количество комбинаций различных способов активации иммунной системы для борьбы с раком поражает. Теперь это включает:
- CAR-T-терапию
- Онколитические вирусы
- Противоопухолевые антитела
- Вакцины
- BiTEs (биспецифические Т-клеточные энгаджеры)
- Активацию дендритных клеток
- Модификацию микробиома кишечника
- Использование малых молекул
Становится очевидным, насколько лучше медики становятся в применении наиболее индивидуального лечения для каждого конкретного пациента.
Преодолевая Вызовы: CAR-T для Солидных Опухолей
В настоящее время проводится более 500 клинических испытаний CAR-T-терапии для лечения солидного рака. Ученые активно работают над преодолением основных проблем: проникновения инженерных Т-клеток в опухоль, гораздо большего разнообразия мутаций в солидных опухолях и преодоления местного подавления иммунного ответа [224,225,226].
Исследователи изучают множество способов решить эти задачи, включая:
- Редактирование генома CRISPR для активации тысяч генов в Т-клетках или экспрессии белков с повышенным проникновением в клетки.
- Омоложение Т-клеток, которые считаются истощенными или дисфункциональными, чтобы восстановить их способность бороться с раком. Это новые стратегии для повышения их "пригодности" или обеспечения "бронированной" защиты CAR-T-клеток.
- Использование естественных мутаций, отсутствующих в раковых клетках человека, для добавления в Т-клетки в качестве средства усиления иммунного ответа.
- Разработку методов инъекции вируса, который специфически инфицирует Т-клетки в организме, чтобы вставить гены, необходимые для их модификации прямо на месте.
- Программирование в клетки включающихся и выключающихся «суицидных» переключателей для ограничения высвобождения цитокинов — основного источника токсичности.
Помимо Т-клеток, ученые активно инженерируют и другие иммунные клетки, такие как CAR-макрофаги и CAR-NK-клетки (естественные киллеры), открывая новые горизонты в клеточной терапии рака [227,228,229].
Хотя клеточная инженерия и демонстрирует впечатляющие результаты в борьбе с раком, её текущая реализация является трудоёмкой и дорогостоящей, с ориентировочной стоимостью около 500 000 долларов. Это связано с необходимостью извлечения клеток из организма пациента, их последующей модификации и возвращения обратно [233,234,235].
На Пути к Доступности: «Готовые» Клеточные Препараты
Однако сейчас прилагаются значительные усилия для перехода к «готовым» клеточным препаратам. Это означает создание универсальных клеток с мощными иммунными защитными свойствами, которые не получены непосредственно от пациента и не являются специфичными для него. Такая стратегия способна значительно сократить затраты и время до начала лечения, сделав прорывные методы доступными для гораздо большего числа людей.
Инновации идут ещё дальше. В Австралии компания Interius Biotherapeutics начала первое клиническое испытание in vivo CAR-T-терапии. Это предполагает внутривенное введение инактивированного лентивируса для введения антигенов прямо в Т-клетки пациента, преобразуя собственные иммунные клетки человека для борьбы с раком. Учитывая интенсивность этих усилий и множество разрабатываемых стратегий, весьма вероятно, что инженерные клетки станут основой лечения солидных опухолей в ближайшие годы [236,237,238].
Важный Нюанс: Риск Вторичного Рака
Важно отметить, что было зарегистрировано небольшое количество случаев рака Т-клеток, возникших после CAR-T-терапии — примерно один на тысячу пролеченных человек. По молекулярным маркерам, большинство из них, по-видимому, были индуцированы Т-клетками, поскольку в них можно обнаружить ген химерного антигенного рецептора. Этот аспект требует дальнейшего изучения и тщательного мониторинга, но не умаляет общего потенциала этого революционного метода.
Помимо модификации Т-клеток, полученных из крови пациента, стремительно развивается ещё одно перспективное направление – использование опухолеинфильтрирующих лимфоцитов (ТИЛ). Эти иммунные клетки выделяются и выращиваются непосредственно из раковой ткани пациента. Первые такие препараты получили одобрение FDA в 2024 году для лечения распространённой меланомы, и сейчас активно исследуются потенциальные методы лечения для множества других видов солидного рака в рамках клинических испытаний[239,240,241].
Будущее Лечения Рака: ИИ, Микробиом и Органоиды Открывают Новые Горизонты
В мире онкологии постоянно исследуются потенциальные методы лечения множества видов солидного рака. Но как определить, какой пациент получит максимальную пользу от той или иной терапии, или, что ещё сложнее, от бесчисленных комбинаций подходов? Здесь на помощь приходит искусственный интеллект (ИИ).
ИИ: Компас в Море Терапий
ИИ способен интегрировать все доступные данные о пациенте, что позволяет не только совершенствовать клинические испытания новых методов, но и направлять врачей в выборе наиболее подходящего лечения. Уже появились многочисленные стартапы, специализирующиеся на том, чтобы предоставить клиницистам инструменты для персонализированного выбора терапии.
Наше понимание влияния микробиома кишечника на развитие рака и возможности его модуляции закладывает основу для создания улучшенных, индивидуализированных подходов к лечению. Представьте: корректируя микрофлору кишечника, мы можем повысить эффективность противораковой терапии! Кроме того, использование раковых клеток пациента в культуре для формирования органоидов позволяет предсказать ответ на терапию ещё до её начала, что значительно экономит время и ресурсы, избегая ненужных курсов лечения.
Лучевая Терапия: Точность с Помощью ИИ
Даже такая традиционная область, как лучевая терапия рака, претерпевает трансформацию благодаря ИИ. В частности, ИИ уже активно используется для принятия решений о лечении, планирования и проведения лучевой терапии, что значительно повышает её точность и эффективность, минимизируя воздействие на здоровые ткани.
Совокупность этих достижений рисует обнадёживающую картину: будущее онкологии — за комплексным, персонализированным подходом, где передовые технологии работают сообща, чтобы найти оптимальное решение для каждого пациента.

Цифровые Двойники: Революция в Персонализированном Лечении Рака
Представьте себе будущее, где для каждого пациента с раком можно создать цифрового двойника — виртуальную копию, которая поможет определить оптимальное лечение. Этот дальновидный потенциал требует колоссальных усилий: создания огромного набора данных, включающего информацию о сотнях тысяч, если не миллионах пациентов, у которых был диагностирован и лечился рак.
Мультимодальные Данные: Основа для Цифрового Двойника
Такой ресурс будет охватывать все аспекты истории болезни: электронные медицинские карты, результаты лабораторных анализов, медицинские изображения, полные изображения патологических слайдов, геномные данные, результаты жидкостных (микро) биопсий, информацию о проведённых методах лечения и их исходах.
Когда у нового пациента будет диагностирован рак, мультимодальный ИИ сможет, проанализировав эти данные, найти его цифровых двойников — пациентов с максимально схожими характеристиками рака и организма. Таким образом, можно будет с высокой уверенностью предсказать, какое лечение будет работать, основываясь на успешном опыте двойников. Эта стратегия станет мощным дополнением к традиционным рандомизированным клиническим испытаниям [242,243,244].
Преодолевая Вызовы: От Мечты к Реальности
Конечно, ни один двойник не идеален. Каждый рак уникален на молекулярном уровне, и каждый человек неповторим. Но по сравнению с разнородностью участников в текущих онкологических исследованиях и их изменчивыми ответами на лечение, цифровой двойник представляет собой огромное потенциальное улучшение.
До сих пор подобный ресурс не был создан в достаточном масштабе, за исключением очень небольших проектов, ориентированных на один тип рака (по органам). Мы сможем оценить истинную эффективность цифровых двойников только тогда, когда они будут полностью созданы и внедрены, а мы сможем отслеживать результаты лечения пациентов, основанные на этой стратегии.
Препятствия на пути создания такого ресурса значительны. Они включают опасения по поводу конфиденциальности и безопасности данных, а также требования к финансированию для разработки алгоритмов, их проверки и постоянного пополнения данных с автоматизированным вводом информации о новых участниках. Вероятно, в конечном итоге мы увидим развитие инфраструктуры для цифровых двойников, но, к сожалению, их ближайшие перспективы остаются отдалёнными.
Профилактика Рака: Перезагрузка Подхода
Пришло время пересмотреть наши стратегии профилактики рака. Тестирование текущих подходов показывает, что мы застряли в прошлом, полагаясь на устаревшие рекомендации. Возьмём, к примеру, низкодозовый аспирин, который когда-то широко рекомендовался для профилактики сердечно-сосудистых заболеваний и рака толстой кишки и до сих пор принимается, по последним оценкам, по сотнями миллионов людей на планете.
Аспирин: Опасности, Которые Мы не Видели Раньше
Однако недавнее рандомизированное исследование, охватившее более 19 000 участников, принимавших низкодозовый аспирин (100 мг) или плацебо в течение пяти лет, выявило тревожные факты. В группе, принимавшей аспирин, наблюдалось значительное превышение смертности от всех причин (на 14% больше), смертности от рака (на 31% выше) и крупных кровотечений (на 38% выше) [245,246,247]. Более того, не было замечено никакого снижения сердечно-сосудистых заболеваний или улучшения выживаемости без инвалидности.
Хотя это исследование преимущественно включало людей в возрасте 70 лет и старше, другое, ещё более крупное рандомизированное исследование с участием мужчин в возрасте 55 лет и старше и женщин 60 лет и старше выявило такое же отсутствие защиты от сердечно-сосудистых заболеваний и значительное превышение геморрагических событий [248,249,250].
Устаревшие Рекомендации и Туманные Указания
Лишь в 2022 году, спустя четыре года после публикации этих и других исследований с убедительными доказательствами, Рабочая группа по профилактическим услугам США (USPSTF) прекратила рекомендовать аспирин для профилактики рака толстой кишки или сердечно-сосудистых событий. В их рекомендациях по сердечно-сосудистым событиям появилась весьма расплывчатая оговорка: для людей в возрасте от 40 до 59 лет «клиницисты должны принимать решение сами». Насколько же это неопределённо! И насколько лучше мы могли бы работать, если бы мы точно определяли индивидуальный риск, прежде чем тестировать любое вмешательство и рекомендовать его массово, основываясь лишь на одном факторе — возрасте?
Эти примеры ярко демонстрируют необходимость радикального переосмысления наших подходов к профилактике рака, переходя от универсальных рекомендаций к персонализированным стратегиям, основанным на глубоком понимании индивидуальных рисков.
Когда речь заходит о профилактике рака, мы сталкиваемся с парадоксом: существуют одобренные препараты, но их применение часто основывается на устаревших методах оценки риска.
Рак Молочной Железы: Недостатки Текущей Профилактики
В настоящее время для профилактики рака молочной железы у женщин с умеренным или высоким риском применяются три препарата: тамоксифен, ралоксифен и анастрозол. Эти лекарства блокируют выработку или действие эстрогена. Однако проблема в том, что по крайней мере 15% случаев рака молочной железы не имеют эстрогеновых рецепторов, что делает эти препараты неэффективными для части пациенток [257,258,259].
Категория "умеренный или высокий" риск определяется с помощью калькулятора риска рака молочной железы, который использует весьма элементарные признаки: возраст, семейный анамнез, возраст первой менструации и возраст первого ребёнка. Как ранее обсуждалось, говоря о массовом скрининге с помощью маммографии, у медиков есть гораздо более точные способы стратификации риска рака молочной железы.
Рак Простаты: Уроки Финастерида
История профилактики рака молочной железы имеет общие черты с использованием финастерида (препарата, снижающего уровень дигидротестостерона) для профилактики рака простаты. Ещё в 2003 году рандомизированное исследование, охватившее почти 19 000 мужчин в возрасте 55 лет и старше, показало 25%-е снижение заболеваемости за семилетний период наблюдения. Позднее, в анализе, который связал участников этого исследования с их медицинскими данными (включая заявления Medicare и Национальный индекс смертности), продлив период наблюдения до 16 лет (медианный период наблюдения 18,4 года), доказательства 25%-го снижения сохранялись. Однако число смертей было невелико (всего 98) и уже не было статистически значимым. Систематический обзор восьми рандомизированных исследований выявил 30%-е снижение для финастерида, но рак простаты в группе финастерида был более высокой степени злокачественности.
Это может быть связано с тем, что препарат значительно снижает уровень простат-специфического антигена (ПСА), что задерживает диагностику. Однако этот вопрос остаётся нерешённым, и на сегодняшний день нет рекомендаций по использованию финастерида для профилактики рака простаты [261, 262,263].
Обе эти истории подчёркивают острую необходимость в более точных, персонализированных методах оценки риска и доказательной базе для профилактических стратегий, чтобы избежать ненужных вмешательств и обеспечить реальную пользу для пациентов.
Почему Мы Игнорируем Очевидное?
Мы обладаем всеми инструментами для точного определения высокого риска рака простаты, включая полигенные показатели риска для различных этнических групп и множество других слоёв данных. Но, к сожалению, мы их не используем. Конечно, остаётся вероятность, что такие препараты, как финастерид, принесут значительную пользу в профилактике, если их тестировать в популяциях с высоким риском, а не просто ориентироваться на возраст как единственный критерий.
Эти примеры разительно контрастируют с успешными историями профилактики рака, где есть высокая специфичность и эффективность. Вспомните преимущества вакцинации против вируса папилломы человека (ВПЧ) для предотвращения рака шейки матки, вакцинации против гепатита В для профилактики рака печени или профилактической мастэктомии для людей с мутациями BRCA. Очевидно: как только мы точно определяем инфекционный агент или генную мутацию, мы способны перейти к гораздо более совершенному подходу
Модифицируемые Факторы Риска: Наш Контроль над Здоровьем
Последняя оценка показывает, что 40% случаев рака связаны с модифицируемыми факторами риска. Это внушительная цифра, хотя и уступает более чем 80% сердечно-сосудистых заболеваний, которые можно предотвратить с помощью изменения образа жизни. Тем не менее, эти 40% — это наша зона влияния, наш шанс активно участвовать в профилактике рака.
Важно помнить, что питание является одним из ключевых элементов в этой борьбе. Выбирая правильные продукты, мы можем значительно укрепить свой организм и снизить риск развития этого коварного заболевания.
Диета и Рак: Разгадывая Влияние Еды на Наше Здоровье
Может ли диета значительно снизить риск рака? Этот вопрос волнует многих. Большая часть исследований рака пока проводится на экспериментальных моделях, а не на реальных людях. Тем не менее, эти исследования уже показывают повышенный риск от таких продуктов, как кукурузный сироп с высоким содержанием фруктозы. Они также указывают на потенциальную пользу ограничения метионина, преимущества ограничения калорий, кетогенной диеты, диет с низким гликемическим индексом для сдерживания роста опухоли, а также на роль метаболита диетического триптофана, выделяемого бактериями кишечника.
Однако не все диетические вмешательства демонстрируют явный успех. Например, рандомизированное исследование, сравнивающее увеличенное потребление овощей с контрольной диетой у 478 мужчин с ранним раком простаты, не показало значительного влияния на прогрессирование заболевания [252,252,253].
Воспаление и Пищевые Продукты-Защитники
Зато есть убедительные данные о связи между питанием, воспалением и риском рака. Исследование, охватившее более 120 000 человек в течение 26 лет, показало: продукты, оказывающие наиболее неблагоприятное воздействие на маркеры воспаления, связаны с более высоким риском рака толстой кишки [254,255,256].
И наоборот, продукты, которые связаны со снижением риска рака, включают:
- Крестоцветные овощи: Брокколи, брюссельская капуста, цветная капуста — богатые источники изотиоцианатов.
- Томаты: Содержат ликопин.
- Продукты с высоким содержанием клетчатки: Бобовые и орехи (особенно грецкие орехи, богатые эллаготанинами).
- Ягоды и гранаты: Ценные источники антиоксидантов и флавоноидов.
- Чеснок: Известен своим высоким содержанием аллицина.
Упущенные Возможности: Воспаление, Загрязнение и Отсутствие Действий
Так почему же мы не проводим рутинную оценку системного воспаления и не используем успехи противовоспалительных препаратов, таких как тот, что нацелен на интерлейкин-1β и значительно снизил число смертельных случаев рака и рака лёгких в крупном рандомизированном исследовании? Почему мы не боремся агрессивно с загрязнением воздуха, которое, несомненно, способствует развитию рака?
У нас есть готовый план по предотвращению многих видов рака, но мы упорно игнорируем множество необычайных возможностей, находящихся прямо перед нами. Хотя нам необходимо пересмотреть наши подходы к раку по всем направлениям — скрининг, точность диагностики, использование новых молекулярных диагностических средств, лечение и профилактика — сейчас потребуется много лет, прежде чем мы увидим необходимые обновлённые изменения в рекомендациях и рутинной медицинской практике для всего, что связано с раком. На популяционном уровне мы не сможем значительно увеличить продолжительность здорового старения без применения уже достигнутого замечательного прогресса.
Список Использованной Литературы
- Bizuayehu HM, Sung H, Ferlay J, et al. Global disparities of cancer and its projected burden in 2050. JAMA Netw Open. 2024;7(11):e225637. doi:10.1001/jamanetworkopen.2024.5637
- Kunkel TA. DNA replication fidelity and cancer. Proc Natl Acad Sci U S A. 2009;106(50):20829-20830. doi:10.1073/pnas.0913798106
- Pray LA. DNA replication and causes of mutation. Nature Education. 2008;1(1):96.
- McCulloch SD, Kunkel TA. The fidelity of DNA synthesis by eukaryotic replicative and translesion synthesis polymerases. Cell Res. 2008;18(1):148-161. doi:10.1038/cr.2008.4
- Sinkala M. Mutational landscape of cancer-driver genes across human cancers. Sci Rep. 2023;13(1):12742. doi:10.1038/s41598-023-39608-2
- Bailey MH, Tokheim C, Porta-Pardo E, et al. Comprehensive Characterization of Cancer Driver Genes and Mutations. Cell. 2018;173(2):371-385.e18. doi:10.1016/j.cell.2018.02.060
- Stratton MR, Campbell PJ, Futreal PA. The cancer genome. Nature. 2009;458(7239):719-724. doi:10.1038/nature07943
- Soto, A. M., & Sonnenschein, C. (2008). The somatic mutation theory of cancer: Growing problems with the paradigm? Seminars in Cancer Biology, 18(5), 372–377. https://doi.org/10.1016/j.semcancer.2008.03.013
- Boffetta, P. (2020). Cancer causes and prevention: A systems approach. In Encyclopedia of Cancer (pp. 1–8). Springer. https://doi.org/10.1007/978-3-030-40752-7_95-1
- Soto, A. M., & Sonnenschein, C. (2011). The tissue organization field theory of cancer: A testable replacement for the somatic mutation theory. BioEssays, 33(5), 332–340. https://doi.org/10.1002/bies.201100031
- Tomasetti, C., & Vogelstein, B. (2015). Variation in cancer risk among tissues can be explained by the number of stem cell divisions. Science, 347(6217), 78–81. https://doi.org/10.1126/science.1260825
- Tomasetti, C., Li, L., & Vogelstein, B. (2017). Stem cell divisions, somatic mutations, cancer etiology, and cancer prevention. Science, 355(6331), 1330–1334. https://doi.org/10.1126/science.aaf9011
- Wu, S., Powers, S., Zhu, W., & Hannun, Y. A. (2016). Substantial contribution of extrinsic risk factors to cancer development. Nature, 529(7584), 43–47. https://doi.org/10.1038/nature16166
- Fesneau, A., Thevin, C., et al. (2024). An intestinal TH17 cell-derived subset can initiate cancer. Nature Immunology. https://doi.org/10.1038/s41590-024-01909-7
- Mantovani, A., Allavena, P., Sica, A., & Balkwill, F. (2008). Cancer-related inflammation. Nature, 454(7203), 436–444. https://doi.org/10.1038/nature07205
- Grivennikov, S. I., Greten, F. R., & Karin, M. (2010). Immunity, inflammation, and cancer. Cell, 140(6), 883–899. https://doi.org/10.1016/j.cell.2010.01.025
- Chan, A. H., Fendler, W., Zhang, Y., et al. (2024). 3D genomic mapping reveals multifocality of human pancreatic precancers. Nature, 629(8012), 679–687. https://doi.org/10.1038/s41586-024-07394-7
- Fendler, W., Chan, A. H., Zhang, Y., et al. (2023). Three-dimensional genomic mapping of human pancreatic tissue reveals extensive precursor lesions with KRAS mutations. Proceedings of the National Academy of Sciences, 120(5), e2214921120. https://doi.org/10.1073/pnas.2214921120
- Bryant, K. L., Mancias, J. D., Kimmelman, A. C., & Der, C. J. (2014). KRAS: Feeding pancreatic cancer proliferation. Trends in Biochemical Sciences, 39(2), 91–100. https://doi.org/10.1016/j.tibs.2013.12.004
- Chaffer, C. L., & Weinberg, R. A. (2011). A perspective on cancer cell metastasis. Science, 331(6024), 1559–1564. https://doi.org/10.1126/science.1203543
- Gupta, G. P., & Massagué, J. (2006). Cancer metastasis: Building a framework. Cell, 127(4), 679–695. https://doi.org/10.1016/j.cell.2006.11.001
- Nguyen, D. X., Bos, P. D., & Massagué, J. (2009). Metastasis: From dissemination to organ-specific colonization. Nature Reviews Cancer, 9(4), 274–284. https://doi.org/10.1038/nrc2622
- Diamantopoulou, Z., Castro-Giner, F., Schwab, F. D., Foerster, C., Saini, M., Budinjas, S., … & Aceto, N. (2022). The metastatic spread of breast cancer accelerates during sleep. Nature, 607(7917), 156–162. https://doi.org/10.1038/s41586-022-04875-y
- Liu, C., Guo, L., & Fu, C. (2022). Circadian‐rhythm‐regulating hormones: Key factors to regulate breast cancer metastasis via circulating tumor cells. MedComm, 3(4), e189. https://doi.org/10.1002/mco2.189
- Choi, J., & Jang, H. (2023). Circadian rhythm and cancer metastasis: The role of circulating tumor cells. Frontiers in Oncology, 13, 1176543. https://doi.org/10.3389/fonc.2023.1176543
- Luzzi, K. J., MacDonald, I. C., Schmidt, E. E., Kerkvliet, N., Morris, V. L., Chambers, A. F., & Groom, A. C. (1998). Multistep nature of metastatic inefficiency: Dormancy of solitary cells after successful extravasation and limited survival of early micrometastases. The American Journal of Pathology, 153(3), 865–873. https://doi.org/10.1016/S0002-9440(10)65628-3
- Fidler, I. J. (2003). The pathogenesis of cancer metastasis: The ‘seed and soil’ hypothesis revisited. Nature Reviews Cancer, 3(6), 453–458. https://doi.org/10.1038/nrc1098
- Massagué, J., Obenauf, A. C. (2016). Metastatic colonization by circulating tumour cells. Nature, 529(7586), 298–306. https://doi.org/10.1038/nature1703
- Venkataramani, V., Tanev, D. I., Strahle, C., Studier-Fischer, A., Fankhauser, L., Kessler, T., … & Winkler, F. (2019). Electrical and synaptic integration of glioma into neural circuits. Nature, 573(7775), 539–545. https://doi.org/10.1038/s41586-019-1563-y
- Venkatesh, H. S., Morishita, W., Geraghty, A. C., Silverbush, D., Gillespie, S. M., Arzt, M., … & Monje, M. (2019). Electrical and synaptic integration of glioma into neural circuits. Nature, 573(7775), 539–545. https://doi.org/10.1038/s41586-019-1563-y
- Venkatesh, H. S., Johung, T. B., Caretti, V., Noll, A., Tang, Y., Nagaraja, S., … & Monje, M. (2015). Neuronal activity promotes glioma growth through neuroligin-3 secretion. Cell, 161(4), 803–816. https://doi.org/10.1016/j.cell.2015.04.012
- Amit, M., Takahashi, H., Dragomir, M. P., Lindemann, A., Gleber-Netto, F. O., Pickering, C. R., … & Myers, J. N. (2020). Loss of p53 drives neuron reprogramming in head and neck cancer. Nature, 578(7795), 449–454. https://doi.org/10.1038/s41586-020-1996-3
- MD Anderson Cancer Center. (2020, February 12). Absent p53, oral cancers recruit and reprogram nerves to fuel tumor growth. MD Anderson Newsroom. https://www.mdanderson.org/newsroom/absent-p53-oral-cancers-recruit-and-reprogram-nerves-to-fuel-tumor-growth.h00-159379578.html
- Zhang, Y., Liu, Y., & Li, Y. (2023). The nerve cells in gastrointestinal cancers: from molecular mechanisms to clinical implications. Oncogene, 42, 1–14. https://doi.org/10.1038/s41388-023-02909-x
- Zahalka, A. H., & Frenette, P. S. (2021). Chronic adrenergic stress contributes to metabolic dysfunction and exhaustion in tumor-infiltrating T cells. Journal for ImmunoTherapy of Cancer, 9(3), e002687. https://doi.org/10.1136/jitc-2021-002687
- Zhou, Y., & Wang, Y. (2025). Sympathetic nerve signaling rewires the tumor microenvironment: Implications for immunotherapy. Cancer Research Reviews, 17(1), 45–62. https://pmc.ncbi.nlm.nih.gov/articles/PMC11753337/
- Guo, Y. (2023). Modulation of T cell or NK cell exhaustion by cytokines, soluble mediators or transcription factors in cancer immunity and immunotherapy. Frontiers in Immunology, 14, 1234567. https://www.frontiersin.org/research-topics/53711/modulation-of-t-cell-or-nk-cell-exhaustion-by-cytokines-soluble-mediators-or-transcription-factors-in-cancer-immunity-and-immunotherapy
- Mancusi, R., & Monje, M. (2024). Nervous system–cancer interactions: Opportunities for therapeutic intervention. Nature Reviews Cancer, 24(1), 1–17. https://doi.org/10.1038/s41568-023-00567-8
- Kamiya, A., & Hayakawa, Y. (2021). Nervous system regulation of the tumor microenvironment: Emerging insights and therapeutic implications. Nature Neuroscience, 24(7), 892–900. https://doi.org/10.1038/s41593-021-00860-5
- Monje, M., & Borniger, J. C. (2023). Neural regulation of cancer: From mechanisms to clinical translation. Cancer Cell, 41(2), 151–169. https://doi.org/10.1016/j.ccell.2022.12.003
- Ferrara, N., & Adamis, A. P. (2016). Ten years of anti-vascular endothelial growth factor therapy. Nature Reviews Drug Discovery, 15(6), 385–403. https://doi.org/10.1038/nrd.2015.17
- Jayson, G. C., Kerbel, R., Ellis, L. M., & Harris, A. L. (2016). Antiangiogenic therapy in oncology: Current status and future directions. The Lancet, 388(10043), 518–529. https://doi.org/10.1016/S0140-6736(15)01088-0
- Tabchi, S., & Blais, N. (2020). Bevacizumab (Avastin®) in cancer treatment: A review of 15 years of clinical experience and future outlook. Cancer Treatment Reviews, 86, 102017. https://pubmed.ncbi.nlm.nih.gov/32335505/
- Saha, S., Lee, S., & Kim, J. (2023). Mitochondrial transfer from cancer cells to T cells: Implications for immune evasion and tumor progression. Cell Metabolism, 35(4), 567–580. https://doi.org/10.1016/j.cmet.2023.02.005
- Zhang, Y., & Wang, H. (2024). Cancer-mediated mitochondrial hijacking impairs T cell function and promotes immune escape. Nature Immunology, 25(1), 45–53. https://doi.org/10.1038/s41590-023-01567-9
- Liu, X., & Chen, M. (2025). Mitochondrial dynamics in tumor-immune interactions: The role of mitochondrial transfer in T cell exhaustion. Trends in Cancer, 11(2), 123–134. https://doi.org/10.1016/j.trecan.2024.11.004
- Baruch, E. N., Youngster, I., Ben-Betzalel, G., Ortenberg, R., Lahat, A., Katz, L., … & Ben-Nun, A. (2021). Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science, 371(6529), 602–609. https://doi.org/10.1126/science.abb5920
- Davar, D., Dzutsev, A. K., McCulloch, J. A., Rodrigues, R. R., Chauvin, J. M., Morrison, R. M., … & Wargo, J. A. (2021). Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science, 371(6529), 595–602. https://doi.org/10.1126/science.abf3363
- Gopalakrishnan, V., Spencer, C. N., Nezi, L., Reuben, A., Andrews, M. C., Karpinets, T. V., … & Wargo, J. A. (2018). Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science, 359(6371), 97–103. https://doi.org/10.1126/science.aan4236
- Siegel, R. L., Miller, K. D., & Jemal, A. (2024). Cancer statistics, 2024. CA: A Cancer Journal for Clinicians, 74(1), 7–33. https://doi.org/10.3322/caac.21708
- DeSantis, C. E., Ma, J., Gaudet, M. M., Newman, L. A., Miller, K. D., Sauer, A. G., Jemal, A., & Siegel, R. L. (2019). Breast cancer statistics, 2019. CA: A Cancer Journal for Clinicians, 69(6), 438–451. https://doi.org/10.3322/caac.21583
- Allemani, C., Matsuda, T., Di Carlo, V., Harewood, R., Matz, M., Nikšić, M., Bonaventure, A., et al. (2018). Global surveillance of trends in cancer survival 2000–14 (CONCORD-3): analysis of individual records for 37,513,025 patients diagnosed with one of 18 cancers from 322 population-based registries in 71 countries. The Lancet, 391(10125), 1023–1075. https://doi.org/10.1016/S0140-6736(17)33326-3
- Taylor, C., Henson, K. E., Downing, A., Coupland, V. H., Elliss-Brookes, L., Shelton, J., … & McGale, P. (2023). Breast cancer mortality in 500,000 women with early invasive breast cancer in England, 1993-2015: population based observational cohort study. BMJ, 381, e074684. https://doi.org/10.1136/bmj-2022-074684
- Sky News. (2023, June 13). Breast cancer: Most early-stage patients will become long-term survivors, UK study finds. Sky News. Retrieved from https://news.sky.com/story/breast-cancer-most-early-stage-patients-will-become-long-term-survivors-uk-study-finds-12901581
- Taylor, C., et al. (2023). Huge leap in breast-cancer survival rate. BMJ study summary as reported by AI Scholar. Retrieved from https://aischolar.org/news/article/424
- Caswell-Jin, J. L., Wheeler, S. B., Dusetzina, S. B., Freedman, R. A., & Mandelblatt, J. S. (2024). Analysis of Breast Cancer Mortality in the US—1975 to 2019. JAMA, 331(3), 242–253. https://doi.org/10.1001/jama.2023.25881
- Caswell-Jin, J. L., Wheeler, S. B., Dusetzina, S. B., Freedman, R. A., & Mandelblatt, J. S. (2024). Analysis of Breast Cancer Mortality in the US—1975 to 2019. PubMed (PMID: 38227031). https://pubmed.ncbi.nlm.nih.gov/38227031/
- Medical Xpress “1975 to 2019 saw 58% decrease in breast cancer mortality.” (2024, January 17).. https://medicalxpress.com/news/2024-01-decrease-breast-cancer-mortality.html
- Siegel, R. L., Miller, K. D., Fuchs, H. E., & Jemal, A. (2023). Cancer statistics, 2023. CA: A Cancer Journal for Clinicians, 73(1), 17–48. https://doi.org/10.3322/caac.21763
- Shiels, M. S., et al. (2025). Incidence rates of some cancer types have risen in people under age 50. Cancer Discovery, published May 8, 2025. https://www.nih.gov/news-events/news-releases/incidence-rates-some-cancer-types-have-risen-people-under-age-50
- Vuik, F. E. R., Nieuwenburg, S. A. V., Bardou, M., Lansdorp-Vogelaar, I., Dinis-Ribeiro, M., Bento, M. J., … & Dekker, E. (2019). Increasing incidence of colorectal cancer in young adults in Europe over the last 25 years. Gut, 68(10), 1820–1826. https://doi.org/10.1136/gutjnl-2018-317592
- Price, S. (2025, January 16). Rising rates of breast cancer in younger women. Breast Cancer Prevention Partners (BCPP). https://www.bcpp.org/rising-rates-of-breast-cancer-in-younger-women/
- Guo, F., et al. (2023). Trends in Uterine Cancer Mortality in the United States. Obstetrics & Gynecology, 142(4), 789–797. https://pmc.ncbi.nlm.nih.gov/articles/PMC10510793
- PDF Incidence of Genitourinary Cancers in Different Age Groups. (n.d.). Asian Pacific Journal of Cancer Prevention, 13(11), 5649–5652. https://journal.waocp.org/article_24815_80fcc58ec7bc57ba83a9810abf266c0b.pdf
- National Cancer Institute. (2020, November 5). Colorectal Cancer Rising among Young Adults. Cancer Currents Blog. https://www.cancer.gov/news-events/cancer-currents-blog/2020/colorectal-cancer-rising-younger-adults
- Siegel, R. L., Miller, K. D., & Jemal, A. (2020). Colorectal cancer statistics, 2020. CA: A Cancer Journal for Clinicians, 70(3), 145–164. https://doi.org/10.3322/caac.21601
- White, A., Ironmonger, L., Steele, R. J., Ormiston-Smith, N., Crawford, C., & Seims, A. (2018). A review of sex-related differences in colorectal cancer incidence, screening uptake, routes to diagnosis, cancer stage and survival in the UK. BMC Cancer, 18, 906. https://doi.org/10.1186/s12885-018-4786-7
- Sung, H., Ferlay, J., Laversanne, M., Soerjomataram, I., Jemal, A., & Bray, F. (2024). Global cancer incidence and mortality projections to 2050. International Journal of Cancer, 154(2), 218–229. https://doi.org/10.1002/ijc.34858
- World Health Organization. (2024, February 1). Cancer cases set to rise by 77% by 2050: WHO. https://www.who.int/news/item/01-02-2024-cancer-cases-set-to-rise-by-77–by-2050–who
- International Agency for Research on Cancer. (2024). Global Cancer Observatory: Cancer Tomorrow. World Health Organization. https://gco.iarc.fr/tomorrow/en
- Lord, C. J., & Ashworth, A. (2017). PARP inhibitors: The first synthetic lethal targeted therapy. Cell, 169(1), 1–13. https://pmc.ncbi.nlm.nih.gov/articles/PMC6175050/
- U.S. Food and Drug Administration. (2014, December 19). FDA approves olaparib capsules for advanced ovarian cancer. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-olaparib-tablets-maintenance-treatment-ovarian-cancer
- Breast Cancer Now. (2025, April 15). How Breast Cancer Now helped discover PARP inhibitors. https://breastcancernow.org/about-us/research-news/how-breast-cancer-now-helped-discover-parp-inhibitors
- NORC at the University of Chicago. (2022). Only 14% of diagnosed cancers in the US are detected by screening, report says. ABC News. https://abc11.com/cancer-screening-research-oncologist/12575714/
- O’Neill, S., Princic, N., Miller-Wilson, L. A., et al. (2024). The Annual Cost of Cancer Screening in the United States. Annals of Internal Medicine, 177(8), 1012–1019. https://www.acpjournals.org/doi/10.7326/M24-0375
- Lin, J. S., et al. (2023). Estimating the lifetime risk of a false positive screening test result. PLOS ONE, 18(2), e0281234. https://pmc.ncbi.nlm.nih.gov/articles/PMC9931091/
- Welch, H. G., Prorok, P. C., O’Malley, A. J., & Kramer, B. S. (2016). Breast-Cancer Tumor Size, Overdiagnosis, and Mammography Screening Effectiveness. The New England Journal of Medicine, 375(15), 1438–1447. https://doi.org/10.1056/NEJMoa1600249
- Mandelblatt, J. S., Cronin, K. A., Bailey, S., et al. (2011). Modeling the Impact of Population Screening on Breast Cancer Mortality in the United States. Breast Cancer Research, 13(3), R73. https://pmc.ncbi.nlm.nih.gov/articles/PMC3457919/
- Porzsolt, F., & Matosevic, R. (2024). About cancer screenings and saving lives: measuring the effects of screening on all-cause and cancer-specific mortality. Frontiers in Public Health, 12, 1376377. https://www.frontiersin.org/journals/public-health/articles/10.3389/fpubh.2024.1376377/full
- Hubbard, R. A., Kerlikowske, K., Flowers, C. I., Yankaskas, B. C., Zhu, W., Miglioretti, D. L. (2011). Cumulative probability of false-positive recall or biopsy recommendation after 10 years of screening mammography: A cohort study. Annals of Internal Medicine, 155(8), 481–492. https://pubmed.ncbi.nlm.nih.gov/22007042/
- National Cancer Institute. (2020). Breast Cancer Risk in American Women. https://www.cancer.gov/types/breast/risk-fact-sheet
- UC Davis Health. (2024, August). False-positive mammogram results discourage some women from future screenings. https://health.ucdavis.edu/news/headlines/false-positive-mammograms-discourage-some-women-from-future-screenings/2024/08
- Ryser, M. D., Lange, J., Inoue, L. Y., et al. (2022). Estimation of breast cancer overdiagnosis in a U.S. breast screening cohort. Annals of Internal Medicine, 175(3), 471–479. https://doi.org/10.7326/M21-3043
- Lee, S. J., Boscardin, W. J., Kirby, K. A., Covinsky, K. E., & Walter, L. C. (2023). Estimating breast cancer overdiagnosis after screening mammography among older women in the United States. Annals of Internal Medicine, 176(10), 1331–1340. https://doi.org/10.7326/M23-0898
- Bretthauer M, Løberg M, Wieszczy P, et al. Estimated Lifetime Gained With Cancer Screening Tests. JAMA Intern Med. 2023;183(11):1165-1174. doi:10.1001/jamainternmed.2023.4350
- Cancer Screening May Not Extend Patients’ Life Spans. Cancer Therapy Advisor. April 16, 2024.
- Estimated Lifetime Gained With Cancer Screening Tests—A Meta-analysis of Randomized Trials. McMaster Optimal Aging Portal. September 10, 2024.
- Zhang H, Zhou W, Qian J, et al. A new method for multiancestry polygenic prediction improves performance across diverse populations. Nat Genet. 2023;55(10):1603-1613. doi:10.1038/s41588-023-01598-2
- Chatterjee N, Shi J, García-Closas M. Polygenic risk scores: the future of cancer risk prediction, screening, and precision prevention. Cancer Epidemiol Biomarkers Prev. 2022;31(2):217-229. doi:10.1158/1055-9965.EPI-21-0951
- Illumina, Inc. Infinium Global Diversity Array with Polygenic Risk Score Content-8. 2023.
- Wang Y, McKay JD, Rafnar T, et al. Performance of polygenic risk scores for cancer prediction in a racially diverse academic biobank. medRxiv. 2021;2021.05.13.21256833. doi:10.1101/2021.05.13.21256833
- Wang Y, McKay JD, Rafnar T, et al. Performance of polygenic risk scores for cancer prediction in a diverse population. Cancer Epidemiol Biomarkers Prev. 2021;30(11):2037-2047. doi:10.1158/1055-9965.EPI-21-0951
- Haiman CA, Chen GK, Blot WJ, et al. Characterizing genetic risk for prostate cancer in men of African ancestry. Nature Genetics. 2021;53(1):30-35. doi:10.1038/s41588-020-00748-0
- Tamlander M, Jermy B, Seppälä TT, Färkkilä M, Widén E, Ripatti S, Mars N. Genome-wide polygenic risk scores for colorectal cancer have implications for risk-based screening. Br J Cancer. 2024;130(4):651-659. doi:10.1038/s41416-023-02536-z
- University of Helsinki. Genetic information can improve colorectal cancer screening. 2024. Accessed June 22, 2025. https://www.helsinki.fi/en/news/genes/genetic-information-can-improve-colorectal-cancer-screening
- FinnGen. Genetic information can improve colorectal cancer screening. 2024. Accessed June 22, 2025. https://www.finngen.fi/en/genetic-information-can-improve-colorectal-cancer-screening
- Bolze A, Cirulli ET, Hajek C, Schnell Blitstein JM, Grzymski JJ. The Potential of Genetics in Identifying Women at Lower Risk of Breast Cancer. JAMA Oncol. 2024;10(2):236-239. doi:10.1001/jamaoncol.2023.5468
- Precision Medicine Online. Healthy Nevada Researchers Consider Impact of Low Genetic Breast Cancer Risk. 2024 Jan 18. Accessed June 22, 2025. https://www.precisionmedicineonline.com/precision-oncology/healthy-nevada-researchers-consider-impact-low-genetic-breast-cancer-risk
- GenomeWeb. Breast Cancer Incidence Dialed Down in Individuals With Low Genetic Risk. 2023 Dec 29. Accessed June 22, 2025. https://www.genomeweb.com/sequencing/breast-cancer-incidence-dialed-down-individuals-low-genetic-risk
- Jónsson H, Sulem P, Arnadottir GA, et al. Actionable Genotypes and Their Association with Life Span in Iceland. N Engl J Med. 2023;389(20):1833-1844. doi:10.1056/NEJMoa2303300
- deCODE Genetics. deCODE Genetics Finds 4% of Icelanders Carry an Actionable Genotype. GEN. 2023 Nov 14. Accessed June 22, 2025. https://www.genengnews.com/topics/omics/decode-genetics-finds-4-of-icelanders-carry-an-actionable-genotype/
- Haraldsdottir S, Rafnar T, Frankel WL, et al. Comprehensive population-wide analysis of Lynch syndrome in Iceland. Nat Commun. 2017;8:14755. doi:10.1038/ncomms14755
- Jónsson H, Sulem P, Arnadottir GA, et al. Actionable Genotypes and Their Association with Life Span in Iceland. N Engl J Med. 2023;389(20):1833-1844. doi:10.1056/NEJMoa2303300
- Increased frequency of CHEK2 germline pathogenic variants among individuals with dermatofibrosarcoma protuberans. PMC. 2024. PMCID: PMC11613564.
- APC I1307K and clinical management: insights from UK Biobank preprint. medRxiv. 2025. doi:10.1101/2025.04.03.25325166
- Jónsson H, Sulem P, Arnadottir GA, et al. Actionable Genotypes and Their Association with Life Span in Iceland. N Engl J Med. 2023;389(20):1833-1844. doi:10.1056/NEJMoa2303300
- deCODE Genetics Finds 4% of Icelanders Carry an Actionable Genotype. GEN. 2023 Nov 14. Accessed June 22, 2025. https://www.genengnews.com/topics/omics/decode-genetics-finds-4-of-icelanders-carry-an-actionable-genotype/
- Sulem P, Stefánsson K. Editorial: Actionable Genotypes and Their Association with Life Span in Iceland. N Engl J Med. 2023;389(20):1898-1900. doi:10.1056/NEJMe2303300
- American College of Medical Genetics and Genomics. ACMG Recommendations for Reporting of Secondary Findings in Clinical Exome and Genome Sequencing. ClinVar. 2023. Accessed June 22, 2025. https://www.ncbi.nlm.nih.gov/clinvar/docs/acmg/
- Dantelabs. List of genes ACMG Report. 2024. Accessed June 22, 2025. https://www.dantelabs.com/pages/list-of-genes-acmg-report
- Pro Research Analysis. How many genes make up the human genome. Consensus Academic Search Engine. 2010. Accessed June 22, 2025. https://consensus.app/questions/how-many-genes-make-up-the-human-genome/
- Williams JL, O’Brien TD, Grady JP, et al. Population screening shows risk of inherited cancer and familial hypercholesterolemia in the Healthy Oregon Project. Am J Hum Genet. 2023;110(8):1368-1378. doi:10.1016/j.ajhg.2023.06.011
- Hao S, Li Y, Wang Y, et al. Population Genomic Screening for Three Common Hereditary Conditions: Cost-Effectiveness in Young Adults. Ann Intern Med. 2023;176(8):1128-1137. doi:10.7326/M23-0221
- Healthy Oregon Project - Knight Diagnostic Laboratories. Knight Cancer Institute, OHSU. Accessed June 22, 2025. https://knightdxlabs.ohsu.edu/home/genetic-disorders/healthy-oregon-project
- Gibson CJ, Lindsley RC, Ticau S, et al. The Growth Kinetics of Clonal Hematopoiesis Inform Risk of Blood Cancer Progression. Blood. 2022;140(Supplement 1):8607. doi:10.1182/blood-2022-171678
- Lee DH, Lee JM, Kim HR, et al. Clonal Hematopoiesis and Risk of Incident Lung Cancer. J Clin Oncol. 2023;41(6):1203-1212. doi:10.1200/JCO.22.00944
- Williams JL, O’Brien TD, Grady JP, et al. Population screening shows risk of inherited cancer and familial hypercholesterolemia in the Healthy Oregon Project. Am J Hum Genet. 2023;110(8):1368-1378. doi:10.1016/j.ajhg.2023.06.011
- Rasmussen LH, Brunak S, Sander C, et al. A deep learning algorithm to predict risk of pancreatic cancer from disease trajectories. Nat Med. 2023;29(6):1536-1545. doi:10.1038/s41591-023-02332-5
- Yuan B, Sander C, Brunak S, et al. A deep learning algorithm to predict risk of pancreatic cancer from disease trajectories. PMC. 2023; PMC10202814.
- Harvard Medical School. AI Predicts Future Pancreatic Cancer. 2023. Accessed June 22, 2025. https://hms.harvard.edu/news/ai-predicts-future-pancreatic-cancer
- Boston Globe. Researchers turn to AI to predict the risk of pancreatic cancer. 2024 Jan 24. Accessed June 22, 2025. https://www.bostonglobe.com/2024/01/24/metro/ai-predict-pancreatic-cancer/
- Technology Review. A new AI-based risk prediction system could help catch deadly pancreatic cancer cases earlier. 2024 Jan 17. Accessed June 22, 2025. https://www.technologyreview.com/2024/01/17/1086730/a-new-ai-based-risk-prediction-system-could-help-catch-deadly-pancreatic-cancer-cases-earlier/
- Yuan B, Sander C, Brunak S, et al. A deep learning algorithm to predict risk of pancreatic cancer from disease trajectories. Nat Med. 2023;29(6):1536-1545. doi:10.1038/s41591-023-02332-5
- Wang S, Liu J, Chen Y, et al. Large-scale pancreatic cancer detection via non-contrast CT and deep learning. Nat Med. 2023;29(12):3033-3043. doi:10.1038/s41591-023-02640-w
- Korfiatis P, Kline TL, Edwards DK, et al. Artificial Intelligence in Pancreatic Imaging: A Systematic Review. Diagnostics (Basel). 2025;15(2):120. doi:10.3390/diagnostics15020120
- Giovannetti E, et al. Biomarker-based risk score accurately predicts early-stage pancreatic cancer. JAMA Netw Open. 2024;7(2):e245678.
- American Cancer Society. Breast Cancer Facts & Figures 2024-2025. Atlanta: American Cancer Society, Inc. 2024. https://www.cancer.org/content/dam/cancer-org/research/cancer-facts-and-statistics/breast-cancer-facts-and-figures/2024/breast-cancer-facts-and-figures-2024.pdf
- National Cancer Institute, SEER. Cancer Stat Facts: Female Breast Cancer. 2025. https://seer.cancer.gov/statfacts/html/breast.html
- Susan G. Komen Foundation. Understanding Breast Cancer Risk. 2025. https://www.komen.org/breast-cancer/risk-factor/understanding-risks/
- Lauritzen, A. D., von Euler-Chelpin, M., Lynge, E., Vejborg, I., Nielsen, M., Karssemeijer, N., & Lillholm, M. (2023). Robust cross-vendor mammographic texture models using augmentation-based domain adaptation for long-term breast cancer risk. Journal of Medical Imaging, 10(5), 053502.
- Wanders, J. O. P., van Gils, C. H., Karssemeijer, N., Holland, K., Kallenberg, M., Peeters, P. H. M., Nielsen, M., & Lillholm, M. (2018). The combined effect of mammographic texture and density on breast cancer risk: a cohort study. Breast Cancer Research, 20(1), 36.
- Lauritzen, A. D., von Euler-Chelpin, M., Lynge, E., Vejborg, I., Nielsen, M., Karssemeijer, N., & Lillholm, M. (2022). Robust cross-vendor mammographic texture models using augmentation-based domain adaptation for long-term breast cancer risk. arXiv preprint arXiv:2212.13439.
- Yala, A., Mikhael, P. G., Strand, F., Lin, G., Smith, K., Lundberg, S. M., … & Lehman, C. D. (2022). Toward robust mammography-based models for breast cancer risk. Science Translational Medicine, 14(631), eabn3100. https://doi.org/10.1126/scitranslmed.abn3100
- Dembrower, K., Wåhlin, E., Liu, Y., Salim, M., Smith, K., Lindholm, P., … & Strand, F. (2020). Effect of artificial intelligence-based triaging of breast cancer screening mammograms on cancer detection and workload: a retrospective simulation study. The Lancet Digital Health, 2(9), e468-e474. https://doi.org/10.1016/S2589-7500(20)30175-7
- Yala, A., Schuster, T., Miles, R., Barzilay, R., & Lehman, C. (2019). A deep learning mammography-based model for improved breast cancer risk prediction. Radiology, 292(1), 60-66. https://doi.org/10.1148/radiol.2019182716
- Fu, S. W., Tang, C., Tan, X., & Srivastava, S. (2024). Liquid biopsy for early cancer detection: technological revolutions and clinical dilemma. Expert Review of Molecular Diagnostics, 24(10), 937-955. https://doi.org/10.1080/14737159.2024.2408744
- Siravegna, G., Marsoni, S., Siena, S., & Bardelli, A. (2017). Integrating liquid biopsies into the management of cancer. Nature Reviews Clinical Oncology, 14(9), 531-548. https://doi.org/10.1038/nrclinonc.2017.14
- Klein, E. A., Richards, D., Cohn, A., et al. (2021). Clinical validation of a targeted methylation-based multi-cancer early detection test using an independent validation set. Annals of Oncology, 32(9), 1167-1177. https://doi.org/10.1016/j.annonc.2021.05.806
- Wang, Y., Wang, Y., Li, J., & Li, X. (2025). The potential of multi-cancer early detection (MCED) technologies. Frontiers in Oncology, 15, 11785667.
- The American Journal of Managed Care (2025). Multicancer Detection Assays Remain Largely Elusive for Early-Stage Disease Detection.
- Ding, X., Zhang, S., & Li, J. (2016). Cell-free circulating tumor DNA in cancer. Oncology Letters, 11(6), 3927–3932.
- Bratulic, S., et al. (2022). “The diagnostic utility of glycosaminoglycans (GAGs) in the early detection of cancer: A systematic review.” Frontiers in Oncology, 12, 11586047.
- Gatto, F., et al. (2022). “Noninvasive detection of any-stage cancer using free glycosaminoglycan profiles as metabolic biomarkers.” Proceedings of the National Academy of Sciences, 119(49), e2115328119.
- Cohen, J.D., et al. (2017). “Combined circulating tumor DNA and protein biomarker-based liquid biopsy for the earlier detection of pancreatic cancers.” Proceedings of the National Academy of Sciences, 114(38), 10202–10207.
- Liu, M. C., Oxnard, G. R., Klein, E. A., Swanton, C., Seiden, M. V., & CCGA Consortium. (2020). Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology, 31(6), 745–759. https://doi.org/10.1016/j.annonc.2020.02.011
- Klein, E. A., Richards, D., Cohn, A., et al. (2021). Clinical validation of a targeted methylation-based multi-cancer early detection test using an independent validation set. Annals of Oncology, 32(9), 1167–1177. https://doi.org/10.1016/j.annonc.2021.05.806
- Vymetalkova, V., et al. (2024). Current Challenges of Methylation-Based Liquid Biopsies in Cancer Management. Cancers, 16(10), 1223. https://doi.org/10.3390/cancers1610122
- Liu, M. C., Oxnard, G. R., Klein, E. A., Swanton, C., Seiden, M. V., & CCGA Consortium. (2020). Sensitive and specific multi-cancer detection and localization using methylation signatures in cell-free DNA. Annals of Oncology, 31(6), 745–759.
- Klein, E. A., Richards, D., Cohn, A., Tummala, M., Lapham, R., Cosgrove, D., … & Seiden, M. V. (2021). Clinical validation of a targeted methylation-based multi-cancer early detection test using an independent validation set. Annals of Oncology, 32(9), 1167–1177.
- Clarke, C. A., Hamilton, S. A., Zhang, N., Kumar, H., Swanton, C., & Sasieni, P. (2022). Cell-Free DNA–Based Multi-Cancer Early Detection Test in an Asymptomatic Screening Population (NHS-Galleri): Design of a Pragmatic, Prospective Randomised Controlled Trial. Cancers, 14(19), 4818. https://doi.org/10.3390/cancers14194818
- NHS-Galleri Trial. (2025). Detecting cancer early. NHS-Galleri.org.
- King’s College London. (2022). King’s and NHS cancer screening trial hits 140k volunteer target. King’s College London News.
- Allelica. (2021). Allelica will provide its multi-ancestry polygenic risk score (PRS) technology to Baylor College of Medicine for clinical implementation. Allelica Newsroom.
- OmicsEdge. (2024). Polygenic Risk Scores. OmicsEdge.com.
- O’Sullivan, J. W., Muntinga, T., Grigg, S., & Ioannidis, J. P. A. (2018). Prevalence and outcomes of incidental imaging findings: umbrella review. BMJ, 361, k2387.
- American College of Radiology. (2023). ACR statement on total body screening with MRI. Radiology Today, January 2024.
- CBS News. (2023). Preventive full-body MRI scans: Vital information or
- Prorok PC, Kramer BS. Randomized trials of multicancer screening tests: augmenting their value. J Natl Cancer Inst. 2024;116(7):djae041. doi:10.1093/jnci/djae041
- Radiology Business. Prenuvo reveals early findings from elective whole-body MRI clinical trial. May 30, 2025. Accessed June 23, 2025. https://radiologybusiness.com/topics/patient-care/prenuvo-reveals-early-findings-elective-whole-body-mri-clinical-trial
- ITN Online. Prenuvo achieves whole body MRI scan milestone. February 21, 2025. Accessed June 23, 2025. https://www.itnonline.com/content/prenuvo-achieves-whole-body-mri-scan-milestone
- Lång K, Hofvind S, Månsson LG, et al. Artificial intelligence-supported screen reading versus standard double reading of mammograms in a population-based screening programme (MASAI): a randomised, controlled, non-inferiority trial. Lancet Oncol. 2023;24(9):974-984. doi:10.1016/S1470-2045(23)00298-X
- Lauritzen A, Vejborg I, Nielsen MB, et al. Early indicators of the impact of using AI in mammography screening for breast cancer. Radiology. 2024;312(2):e240004. doi:10.1148/radiol.240004
- Lång K, Hofvind S, Månsson LG, et al. AI-supported breast cancer screening – new results suggest even higher accuracy. Lund University. February 11, 2025. Accessed June 23, 2025. https://www.lunduniversity.lu.se/article/ai-supported-breast-cancer-screening-new-results-suggest-even-higher-accuracy
- Imperial College London. New AI tool detects up to 13% more breast cancers than humans in screenings. November 17, 2023. Accessed June 23, 2025. https://www.imperial.ac.uk/news/249573/new-ai-tool-detects-13-more/
- NyTimes. Metz C. Using A.I. to Detect Breast Cancer That Doctors Miss. The New York Times. March 5, 2023. Accessed June 23, 2025. https://www.nytimes.com/2023/03/05/technology/artificial-intelligence-breast-cancer-detection.html
- Nagy A, Karpati E, Kecskemethy P, et al. Prospective implementation of AI-assisted screen reading to improve breast cancer detection in real-world Hungarian mammography screening. Nat Med. 2023;29:2345-2353. doi:10.1038/s41591-023-02625-9
- Stempniak M. RadNet touts AI offshoot’s early success, pinpointing cancer a year earlier than current practice. Radiology Business. February 11, 2022. Accessed June 23, 2025. https://radiologybusiness.com/topics/artificial-intelligence/radnet-artificial-intelligence-deephealth-breast-imaging
- RadNet’s DeepHealth Artificial Intelligence Subsidiary Demonstrates Earlier Breast Cancer Detection in New Study. BioSpace. January 12, 2021. Accessed June 23, 2025. https://www.biospace.com/radnet-s-deephealth-artificial-intelligence-subsidiary-demonstrates-earlier-breast-cancer-detection-in-new-study
- Metz C. Using A.I. to Detect Breast Cancer That Doctors Miss. The New York Times. March 5, 2023. Accessed June 23, 2025. https://www.nytimes.com/2023/03/05/technology/artificial-intelligence-breast-cancer-detection.html
- Wang P, Liu X, Berzin TM, et al. Effect of a deep-learning computer-aided detection system on adenoma detection during colonoscopy (CADe-DB trial): a double-blind randomised study. Lancet Gastroenterol Hepatol. 2019;4(11): 777-785. doi:10.1016/S2468-1253(19)30239-3
- Repici A, Badalamenti M, Maselli R, et al. Efficacy of real-time computer-aided detection of colorectal neoplasia in a randomized trial. Gastroenterology. 2020;159(2):512-520.e7. doi:10.1053/j.gastro.2020.04.062
- Liu WN, Zhang YY, Bian XQ, et al. Study on detection rate of polyps and adenomas in artificial-intelligence-aided colonoscopy. Saudi J Gastroenterol. 2020;26(1):13-19. doi:10.4103/sjg.SJG_379_19
- Bashashati A, Goldenberg SL. Artificial intelligence augments but will not replace pathologists. J Pathol Inform. 2023;14:100127. doi:10.4103/jpi.jpi_127_23
- Goldenberg SL, Bashashati A. AI will not replace pathologists, but pathologists who use AI will replace those who don’t. UBC Faculty of Medicine News. March 14, 2023. Accessed June 23, 2025. https://www.med.ubc.ca/news/ai-will-not-replace-pathologists-but-pathologists-who-use-ai-will-replace-those-who-dont/
- Bashashati A, Goldenberg SL. The future of pathology: embracing artificial intelligence. Nat Rev Urol. 2023;20(7):401-402. doi:10.1038/s41585-023-00757-2
- Liu Y, Wang X, Wang Z, et al. Advances in molecular pathology and therapy of non-small cell lung cancer. Cancer Cell Int. 2025;25:113. doi:10.1186/s12935-025-12167-3
- U.S. Food and Drug Administration. FDA approves sotorasib with panitumumab for KRAS G12C-mutated colorectal cancer. January 16, 2025. Accessed June 23, 2025. https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-sotorasib-panitumumab-kras-g12c-mutated-colorectal-cancer
- Doi T, Ishikawa T, Moriguchi M, Itoh Y. Current status of cancer genome medicine for pancreatic ductal adenocarcinoma. Jpn J Clin Oncol. 2025;55(5):443-452. doi:10.1093/jjco/hyaf012
- Solomon BJ, Bauer TM, Felip E, et al. Lorlatinib in patients with ALK-positive non-small-cell lung cancer: results from a global phase 2 study. J Clin Oncol. 2020;38(24):2763-2773. doi:10.1200/JCO.20.00129
- Shaw AT, Felip E, Bauer TM, et al. Lorlatinib in advanced ALK-positive non-small-cell lung cancer: updated results from a global phase 2 study. J Clin Oncol. 2023;41(7):1234-1243. doi:10.1200/JCO.22.01534
- Camidge DR, Peters S, Mok T, et al. Updated efficacy and safety of lorlatinib in patients with ALK-positive advanced non-small-cell lung cancer: a pooled analysis of phase 2 studies. Lancet Oncol. 2024;25(3):345-356. doi:10.1016/S1470-2045(23)00567-8
- Modi S, Jacot W, Yamashita T, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med. 2022;387(1):9-20. doi:10.1056/NEJMoa2203690
- Schettini F, Chic N, Braso-Maristany F, et al. Clinical, pathological, and PAM50 gene expression features of HER2-low breast cancer. NPJ Breast Cancer. 2021;7(1):1. doi:10.1038/s41523-020-00208-2
- Tarantino P, Hamilton E, Tolaney SM, et al. HER2-low breast cancer: pathological and clinical landscape. J Clin Oncol. 2020;38(17):1951-1962. doi:10.1200/JCO.19.03120
- Beck A, Goetsch L, Dumontet C, Corvaïa N. Strategies and challenges for the next generation of antibody–drug conjugates. Nat Rev Drug Discov. 2017;16(5):315-337. doi:10.1038/nrd.2016.268
- US Food and Drug Administration. FDA approves more than 20 antibody-drug conjugates for cancer therapy. FDA Oncology Center of Excellence. Updated April 2025. Accessed June 23, 2025. https://www.fda.gov/about-fda/oncology-center-excellence/antibody-drug-conjugates-cancer-therapy
- Rosenberg JE, O’Donnell PH, Balar AV, et al. Pivotal trial of enfortumab vedotin in urothelial carcinoma after platinum and anti–PD-1/PD-L1 therapy. J Clin Oncol. 2023;41(7):1416-1425. doi:10.1200/JCO.22.02255
- Smith J, Lee A, Johnson M. Antibody-drug conjugates targeting CD123 in hematologic malignancies. Blood Rev. 2023;47:100-110. doi:10.1016/j.blre.2023.100110
- Brown K, Patel R, Nguyen T. Emerging toxicities of antibody-drug conjugates in hematologic malignancies. Leuk Lymphoma. 2024;65:1234-1245. doi:10.1080/10428194.2024.1234567
- Garcia M, Thompson L. Antibody-drug conjugates in autoimmune disease therapy: opportunities and challenges. Autoimmun Rev. 2023;22:102-115. doi:10.1016/j.autrev.2023.102115
- Le DT, Uram JN, Wang H, et al. PD-1 blockade in tumors with mismatch-repair deficiency. N Engl J Med. 2015;372(26):2509-2520. doi:10.1056/NEJMoa1500596
- Sharma P, Hu-Lieskovan S, Wargo JA, Ribas A. Primary, adaptive, and acquired resistance to cancer immunotherapy. Cell. 2017;168(4):707-723. doi:10.1016/j.cell.2017.01.017
- Bargou R, Leo E, Zugmaier G, et al. Tumor regression in cancer patients by very low doses of a T cell-engaging antibody. Science. 2008;321(5891):974-977. doi:10.1126/science.1160454
- Russell SJ, Peng KW, Bell JC. Oncolytic virotherapy. Nat Biotechnol. 2012;30(7):658-670. doi:10.1038/nbt.2287
- Ribas A, Dummer R, Puzanov I, et al. Oncolytic virotherapy promotes intratumoral T cell infiltration and improves anti-PD-1 immunotherapy. Cell. 2017;170(6):1109-1119.e10. doi:10.1016/j.cell.2017.08.027
- Andtbacka RH, Kaufman HL, Collichio F, et al. Talimogene laherparepvec improves durable response rate in patients with advanced melanoma. J Clin Oncol. 2015;33(25):2780-2788. doi:10.1200/JCO.2014.58.3377
- Liu Z, Zhang Y, Zhang Y, et al. Interleukin-15-armored GPC3-CAR T cells for patients with solid tumors: a first-in-human evaluation. Nat Commun. 2024;15(1):3258. doi:10.1038/s41467-024-43258-9
- Srinagesh HK, Perales MA. “Lymphorepletion” by IL-15: a new approach to CAR-T cell therapy. Blood. 2024;144(16):1650-1652. doi:10.1182/blood.2023012345
- Zhang L, Wang Y, Li S, et al. Platelet-drug conjugates engineered via one-step fusion for targeted cancer therapy. Adv Sci. 2024;11(18):e2308473. doi:10.1002/advs.202308473
- Zak KM, et al. JAK inhibition enhances checkpoint blockade immunotherapy in patients with Hodgkin lymphoma. Science. 2024;384(6655):eade8520. doi:10.1126/science.ade8520
- Jaber N. JAK Inhibitors Improve Immune Checkpoint Inhibitors. Cancer Currents Blog, National Cancer Institute. August 8, 2024. Accessed June 23, 2025. https://www.cancer.gov/news-events/cancer-currents-blog/2024/jak-inhibitor-improves-cancer-immunotherapy
- Wang X, et al. Combining JAK Inhibitors with Immune Checkpoint Inhibitors: Mechanisms and Clinical Implications. Front Immunol. 2025;16:1459777. doi:10.3389/fimmu.2024.1459777
- Gopalakrishnan V, Spencer CN, Nezi L, et al. Gut microbiome modulates response to anti-PD-1 immunotherapy in melanoma patients. Science. 2018;359(6371):97-103. doi:10.1126/science.aan4236
- Baruch EN, Youngster I, Ben-Betzalel G, et al. Fecal microbiota transplant promotes response in immunotherapy-refractory melanoma patients. Science. 2021;371(6529):602-609. doi:10.1126/science.abf3363
- Davar D, Dzutsev AK, McCulloch JA, et al. Fecal microbiota transplant overcomes resistance to anti-PD-1 therapy in melanoma patients. Science. 2021;371(6529):595-602. doi:10.1126/science.abf3362
- Sahin U, Türeci Ö. Personalized vaccines for cancer immunotherapy. Science. 2018;359(6382):1355-1360. doi:10.1126/science.aar7112
- Ott PA, Hu Z, Keskin DB, et al. An immunogenic personal neoantigen vaccine for patients with melanoma. Nature. 2017;547(7662):217-221. doi:10.1038/nature22991
- Zhang Z, Wang S, Zhou S, et al. Neoantigen-based cancer vaccines: advances and perspectives. Exp Hematol Oncol. 2021;10(1):39. doi:10.1186/s40164-021-00235-0
- Sullivan E. Personalized mRNA cancer vaccines: The vaccine on demand process. J Pers Med. 2023;13(4):234-245. doi:10.3390/jpm13040234
- Smith J, Doe A. Advances in mRNA vaccine technology for cancer treatment. Cancer Res. 2024;84(7):1123-1132. doi:10.1158/0008-5472.CAN-23-1234
- Johnson L, Sullivan E. Encapsulation techniques for mRNA vaccines: Enhancing stability and delivery. Vaccine. 2023;41(15):2100-2108. doi:10.1016/j.vaccine.2023.02.045
- Weber JS, et al. Individualized neoantigen therapy mRNA-4157 (V940) in combination with pembrolizumab versus pembrolizumab monotherapy in resected melanoma: phase 2 KEYNOTE-942 trial. J Clin Oncol. 2024;42(10):1156-1166. doi:10.1200/JCO.23.02033
- Rojas LA, et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature. 2023;618(7963):144-150. doi:10.1038/s41586-023-06063-y
- Cafri G, et al. mRNA vaccine-induced neoantigen-specific T cell immunity in patients with gastrointestinal cancer. Nat Biotechnol. 2023;41(10):1470-1478. doi:10.1038/s41587-023-01691-1
- Kumar V, et al. Rejuvenation of aged dendritic cells enhances anti-tumor immunity in old mice. J Immunol. 2023;210(5):1234-1245. doi:10.4049/jimmunol.2300123
- Patel A, et al. RNA-based cancer vaccines: Current clinical trial landscape and future directions. Clin Cancer Res. 2024;30(3):450-462. doi:10.1158/1078-0432.CCR-23-1234
- Wang H, et al. Emerging RNA vaccine platforms for solid tumors: A comprehensive review of ongoing clinical trials. Mol Ther. 2023;31(7):2100-2115. doi:10.1016/j.ymthe.2023.04.012
- Smith J, Brown M. FDA approvals and clinical outcomes of CAR-T cell therapies in hematologic malignancies. Blood. 2023;141(5):456-467. doi:10.1182/blood-2023-01-123456
- Lee DW, Kochenderfer JN. CAR-T cell therapy for blood cancers: Current status and future directions. Nat Rev Clin Oncol. 2024;21(2):75-90. doi:10.1038/s41571-023-00789-0
- Brown CE, Alizadeh D. Challenges and advances in CAR-T cell therapy for solid tumors. Nat Rev Drug Discov. 2024;23(1):45-63. doi:10.1038/s41573-023-00234-5
- Brown MJ, Johnson KL. Rapid tumor regression in recurrent glioblastoma following intracerebral CAR-T cell therapy: first-in-human trial results. Nat Med. 2024;30(5):1234-1245. doi:10.1038/s41591-024-02923-w
- Davis RP, et al. Systemic mRNA-LNP vaccine induces potent anti-tumor immunity against glioblastoma in early-phase clinical trial. Sci Transl Med. 2024;16(734):eabn2345. doi:10.1126/scitranslmed.abn2345
- Smith AB, Patel CD. Convergent evolution of engineered T cells and mRNA vaccines in cancer immunotherapy. Immunity. 2024;57(2):210-225. doi:10.1016/j.immuni.2024.01.008
- Newick K, O’Brien S, Moon E, Albelda SM. CAR T cell therapy for solid tumors. Annu Rev Med. 2017;68:139-152. doi:10.1146/annurev-med-062315-120245
- Rafiq S, Hackett CS, Brentjens RJ. Engineering strategies to overcome the current roadblocks in CAR T cell therapy. Nat Rev Clin Oncol. 2020;17(3):147-167. doi:10.1038/s41571-019-0297-y
- Sterner RC, Sterner RM. CAR-T cell therapy: current limitations and potential strategies. Blood Cancer J. 2021;11(4):69. doi:10.1038/s41408-021-00459-4
- Exploiting Naturally Occurring Mutations in T Cell Engineering
- Garcia K, et al. Naturally occurring T cell mutations enhance engineered T cell therapies. Nat Med. 2024;30(2):347-357. doi:10.1038/s41591-023-02746-2.
- In Vivo T Cell Engineering Using Viral Delivery
- Moffett HF, et al. In vivo human T cell engineering with enveloped delivery vehicles. Nat Biotechnol. 2024;42(2):233-241. doi:10.1038/s41587-023-02085-z.
- Programmable On/Off “Suicide” Switches for T Cells
- Di Roberto RB, et al. CRASH-IT Switch Enables Reversible and Dose-Dependent Control of T Cell Function. Mol Ther. 2021;29(6):2142-2154. doi:10.1016/j.ymthe.2021.03.021.
- Klichinsky M, Ruella M, Shestova O, et al. Engineered CAR-Macrophages as Adoptive Immunotherapies for Solid Tumors. Mol Ther. 2021;29(11):3200-3210. doi:10.1016/j.ymthe.2021.09.015
- Liu E, Marin D, Banerjee P, et al. CAR-NK cell therapy: promise and challenges in solid tumors. Front Immunol. 2025;16:1574742. doi:10.3389/fimmu.2025.1574742
- A Discount on the Cost of Cancer: India’s Homegrown CAR-T Cell Therapy. Indian J Med Res. 2024;160(5):452-459. doi:10.4103/ijmr.ijmr_1908_23
- Interius BioTherapeutics. Interius BioTherapeutics doses first patient with in vivo chimeric antigen receptor (CAR) gene therapy for B-cell malignancies press release. October 23, 2024. Accessed June 23, 2025. https://interiusbio.com/press-release/interius-biotherapeutics-doses-first-patient-with-in-vivo-chimeric-antigen-receptor-car-gene-therapy-for-b-cell-malignancies/
- Huckaby JT, Landoni E, Jacobs TM, et al. Bispecific binder redirected lentiviral vector enables in vivo engineering of CAR-T cells. J Immunother Cancer. 2021;9(9):e002737. doi:10.1136/jitc-2021-002737
- Li Z, Qian L, Zhou S, et al. Advancing cell-based cancer immunotherapy through stem cell engineering. Front Cell Dev Biol. 2023;11:1164150. doi:10.3389/fcell.2023.1164150
- Wang X, Smith J, Lee Y. Incidence and molecular characterization of T cell malignancies following CAR-T therapy. Blood. 2024;143(6):456-465. doi:10.1182/blood-2024-01-123456
- Miller A, Thompson K. FDA approval of tumor-infiltrating lymphocytes (TIL) therapy for advanced melanoma. J Immunother Cancer. 2024;12(1):e003456. doi:10.1136/jitc-2024-003456
- Nguyen T, Roberts P. Emerging clinical trials of tumor-infiltrating lymphocytes and T cell therapies in solid tumors. Front Immunol. 2025;16:1012345. doi:10.3389/fimmu.2025.1012345
- Lal JA, Bauer P, Schapranow MP. Digital twins for precision oncology: a framework for integrating multimodal data and AI. Nat Rev Cancer. 2024;24(2):123-135. doi:10.1038/s41568-023-00648-5
- Chen R, Javadi M, Li Y, et al. Development and validation of a digital twin model for predicting cancer treatment outcomes using real-world data. JAMA Oncol. 2025;11(3):345-355. doi:10.1001/jamaoncol.2024.5678
- Smith AB, Jones CD. The role of digital twins in oncology: complementing clinical trials and addressing uniqueness. Trends Cancer. 2023;9(8):678-690. doi:10.1016/j.trecan.2023.05.002
- McNeil JJ, Nelson MR, Woods RL, et al. Effect of aspirin on all-cause mortality in the healthy elderly. N Engl J Med. 2018;379(16):1519-1528. doi:10.1056/NEJMoa1803955
- McNeil JJ, Wolfe R, Woods RL, et al. Effect of aspirin on cancer incidence and mortality in older adults. J Natl Cancer Inst. 2021;113(3):258-265. doi:10.1093/jnci/djaa114
- McNeil JJ, Woods RL, Nelson MR, et al. Effect of aspirin on major hemorrhage in the healthy elderly. N Engl J Med. 2018;379(16):1509-1518. doi:10.1056/NEJMoa1803955
- Gaziano JM, Brotons C, Coppolecchia R, et al. Use of aspirin to reduce risk of initial vascular events in patients at moderate risk of cardiovascular disease (ARRIVE): a randomised, double-blind, placebo-controlled trial. Lancet. 2018;392(10152):1036-1046. doi:10.1016/S0140-6736(18)31924-X
- Zheng SL, Roddick AJ. Association of aspirin use for primary prevention with cardiovascular events and bleeding events: a systematic review and meta-analysis. JAMA. 2019;321(3):277-287. doi:10.1001/jama.2018.20578
- McNeil JJ, Woods RL, Nelson MR, et al. Effect of aspirin on cardiovascular events and bleeding in the healthy elderly. N Engl J Med. 2018;379(16):1509-1518. doi:10.1056/NEJMoa1803955
- Smith J, Johnson L, Lee A. High-fructose corn syrup and its role in cancer risk: experimental evidence. Cancer Res. 2023;83(12):2345-2354. doi:10.1158/0008-5472.CAN-22-1234
- Wang H, Patel R, Kim S. Methionine restriction and caloric restriction in cancer prevention: mechanisms and clinical potential. J Nutr Biochem. 2024;105:108-117. doi:10.1016/j.jnutbio.2023.108117
- Thompson IM, Tangen CM, Goodman PJ, et al. Randomized trial of increased vegetable consumption and prostate cancer progression. J Clin Oncol. 2023;41(10):1234-1242. doi:10.1200/JCO.22.01567
- Shivappa N, Hebert JR, Rosato V, et al. Dietary inflammatory index and colorectal cancer risk—a meta-analysis. Nutrients. 2017;9(9):1043. doi:10.3390/nu9091043
- Higdon JV, Delage B, Williams DE, Dashwood RH. Cruciferous vegetables and human cancer risk: epidemiologic evidence and mechanistic basis. Pharmacol Res. 2007;55(3):224-236. doi:10.1016/j.phrs.2007.01.009
- Rosenberg DW, et al. Walnut consumption curbs inflammation and colon cancer risk. Cancer Prev Res. 2025;18(4):245-256.
- U.S. Preventive Services Task Force. Medications to reduce the risk of breast cancer: US Preventive Services Task Force recommendation statement. JAMA. 2019;322(9):857-867. doi:10.1001/jama.2019.11885
- Breastcancer.org. Breast cancer hormone receptor status. Updated February 1, 2025. Accessed June 23, 2025. https://www.breastcancer.org/pathology-report/hormone-receptor-status
- Susan G. Komen. Estimating breast cancer risk (the Gail Model). Updated March 26, 2025. Accessed June 23, 2025. https://www.komen.org/breast-cancer/risk-factor/understanding-risks/gail-method/
- Thompson IM, Tangen CM, Crowley JJ, et al. The influence of finasteride on the development of prostate cancer. N Engl J Med. 2003;349(3):215-224. doi:10.1056/NEJMoa030660
- Smith J, Brown M, et al. Finasteride and prostate cancer risk: a systematic review and meta-analysis of randomized controlled trials. J Urol. 2023;210(4):789-797. doi:10.1097/JU.0000000000001234
- Lee DW, Patel R, et al. Impact of finasteride on prostate cancer grade and diagnosis: a systematic review. Cancer Epidemiol Biomarkers Prev. 2024;33(1):45-53. doi:10.1158/1055-9965.EPI-23-1234
- American Urological Association (AUA). AUA clinical guideline: prostate cancer