Долголетие: От Науки к Реальности
 Материал подготовлен Алмазом Шарман - президентом Академии профилактической медицины, членом Американской ассоциации здравоохранения
Материал подготовлен Алмазом Шарман - президентом Академии профилактической медицины, членом Американской ассоциации здравоохранения
Введение
Как долго нам суждено жить?
Ответ – 115 лет, а точнее 114,9. Лишь считаные люди прожили дольше этого возраста. Таков вердикт известного генетика Jan Vijg из Медицинского колледжа Альберта Эйнштейна в Нью-Йорке, опубликовавшего статью в престижном научном журнале Nature. Однако лишь два года спустя, в 2018 году в другом престижном журнале Science была опубликована статья демографов Elisabetta Barbi из Римского университета и Kenneth Wachter из Университета Калифорнии Беркли. В ней они отвергли постулат о лимите долголетия.
Ученые показали, что риски смерти неуклонно возрастают по мере достижения 80-летнего возраста, но затем риски снижаются и выходят на плато. Например, тот, кто дожил до 105 лет, имеет 50-процентный шанс прожить еще один год. Причем такое продолжается в 106, 107, 108 и 109-летнем возрасте. Авторы заключили, что долголетие по большому счету лишено ограничений.
А стоит ли быть бессмертным?
На позициях признания лимита долголетия стоит профессор Jay Olshansky, из Университета Иллинойса в Чикаго, полагая что, как никто из людей не может пробежать пять километров за две минуты, так и никому не суждено преодолевать определенный лимит долголетия. На то просто существуют анатомические и биологические ограничения. Однако другой позиции придерживается профессор Steven Austad – биолог из Университета Алабамы в Бирмингеме. Он считает, что среди нас уже присутствует человек, который проживет до 150 лет.
Двое ученых заключили пари, каждый внеся по 150 долларов в созданный ими инвестиционный фонд с расчетом на то, что к 2150 году потомки победившего получат накопленные к тому времени дивиденды. Интересно, что данный фонд уже привлек внимание крупных инвесторов. Его капитализация неуклонно растет, а профессор Olshansky сумел даже инвестировать первоначально накопленные дивиденды в золото и акции Tesla. Он уверен, что к моменту распределения дивидендов в 2150 году цена фонда достигнет одного миллиарда долларов.
Техноолигархи и мечты о бессмертии
Неудивительно, что вопросами долголетия заинтересовались техноолигархи Силиконовой долины. Мотивированные богатством, отменным здоровьем и высоким качеством жизни, у них есть все основания и возможности для того, чтобы стремиться жить долго и красиво. Как сказал известный трансгуманист Йоваль Харари, нынешние техноолигархи Силиконовой долины по уровню престижа, общественного признания и политического влияния напоминают богов древнего Вавилона. Средств на долголетие они жалеть не намерены. Например, с объемом финансирования в полтора миллиарда долларов Google создал компанию Calico (California Life Company), занимающуюся исключительно технологическими разработками в области продления жизни.
Среди философов принято считать, что смерть придает жизни ее смысл. Однако с бессмертием теряется предназначение жизни. В значительной степени артистическое творчество подпитывается боязнью смерти. Как для любого обывателя, так и для миллиардера из Силиконовой долины, смерть – это бесконечная трагедия, которую никто не хотел бы допустить, но не у всех хватает воли и средств, чтобы как-либо этому противостоять. Джефф Безос (Amazon) и Питер Тиль (Y-combinator) пожертвовали $700 млн на то, чтобы разгадать секреты бессмертия. Ларри Эллисон (Oracle) решил инвестировать на это $370 млн, отметив, что «мысли о смерти наводят его на грустные размышления». Ларри Пэйдж (Google) заявил, что он еще «не запланировал умирать». Такое ощущение, будто жизнь и смерть в восприятии техноолигархов – это не фундаментальное проявление природы и эволюции, а посильная технологическая задача, решить которую можно с помощью интеллектуальных ресурсов, необходимых инвестиций, компьютерных алгоритмов и плановых мероприятий.
Именно это и является предметом деятельности группы ученых, которые называют себя «бессмертниками» (immortalists). Они подразделяются на две группы. Одну из них возглавляет британец Обри де Грей – апологет теории сингулярности. Она предполагает, что, будучи в своей плоти, человек имеет неограниченные возможности для ее обновления и совершенствования. Это в конечном итоге и обеспечивает бессмертие.
Другую группу называют «робокопами». Ее возглавляет футурист Рей Курцвейл, которого Ларри Пэйдж пригласил работать в Google научным консультантом по долголетию. Проповедуя идеи трансгуманизма, Рей Курцвейл считает, что в будущем произойдет интеграция (конвергенция) биологической плоти человека с механическими приспособлениями и искусственным интеллектом. Это позволит человеку преодолеть биологические ограничения бытия. Йоваль Харари назвал такое человеческое существо Homo Deus – «человек божественный». В конце концов у всех «бессмертников» есть запасной план – это заморозить себя в жидком азоте до тех пор, пока наука не найдет реального пути к бессмертию.

Рынок долголетия: От элитных клиник до сомнительных практик
В наши дни по всему миру насчитываются тысячи клиник, специализирующихся на продлении жизни — от массовых до элитных, включая престижную Mayo Clinic. Некоторые из них предлагают недельные программы стоимостью до 50 000 долларов. Появились и «отпуска долголетия» с внутривенными инфузиями, «Олимпиады омоложения», эксклюзивные медицинские клубы вроде Fountain Life, предлагающие точную диагностику в формате загородного клуба, и фитнес-центры, сочетающие физическую нагрузку с антиэйдж-терапией.
Развиваются масштабные инициативы — например, премия X-Prize с фондом более 100 миллионов долларов, предназначенная для команд, способных продемонстрировать восстановление не менее десяти лет утраченных функций — мышечной, когнитивной и иммунной — у пожилых людей. Всё это дополняется стволовыми клиниками, обещающими продление жизни за счёт клеточных технологий.
Однако наряду с этим расцветают и сомнительные практики. Некоторые псевдонаучные энтузиасты распространяют непроверенные добавки, делают смелые заявления без доказательной базы и публично делятся своими «режимами долголетия» — например, указанием дозы рапамицина, якобы продлевающей жизнь.
Особое внимание привлекают эксцентричные миллионеры, посвятившие себя идее замедления старения. Один из них - Брайан Джонсон, 46-летний предприниматель, ежедневно принимает более 110 добавок, следит за работой всех органов, включая эрекцию (с помощью специального сенсора в кольце), консультируется с тридцатью медицинскими специалистами, тратит более двух миллионов долларов в год на тщательно выверенное питание (ровно 1977 килокалорий в день) и даже прошёл инфузии плазмы, взятой у собственного сына-подростка, а также курс генной терапии.
На фоне этого в биомедицинской индустрии активно растёт число компаний, разрабатывающих препараты и интервенции для замедления старения, а также предлагающих биомаркеры, отслеживающие биологический возраст. Крупнейшие технологические миллиардеры — Джефф Безос, Сэм Альтман, Юрий Мильнер, Питер Тиль — инвестируют в эти разработки миллионы, если не миллиарды долларов.
Что ими движет? Трудно судить, но слова Венки Рамакришнана из книги «Почему мы умираем» звучат весьма точно: «Когда они были молоды, они хотели быть богатыми. А теперь, когда они богаты — они хотят быть молодыми». Вряд ли эти инвестиции прекратятся в ближайшем будущем — особенно на фоне реального прогресса в понимании биологии старения.
К сожалению, стремление к долголетию привело к избытку надежд, зачастую иррациональных, на всех уровнях — от личных ожиданий до научных гипотез. Давайте разберемся, что действительно известно, что остаётся за пределами нашего понимания и насколько реалистично предположить, что однажды мы сможем — хотя бы частично — модулировать сам процесс старения.

Старение как вызов: демография, болезни и ограничения
Мы стоим на пороге переосмысления самого понятия «старость». Прежде всего, изменилась демография: количество долгожителей неуклонно растёт. Сегодня в мире живёт около миллиона людей в возрасте 100 лет и старше, и, по прогнозам, к 2060 году это число удвоится. Однако рост числа столетних не означает победу над немощью. Фактически, всё указывает на то, что мы остаёмся столь же уязвимыми к возрастным нарушениям, как и прежде — а возможно, даже больше. В результате всё больше людей доживают до глубокой старости, сопровождаемой множественными хроническими заболеваниями.
По данным Всемирной организации здравоохранения, среднестатистический человек после 65 лет отмечает в среднем только один день рождения в состоянии полного здоровья. Это звучит мрачно, но то же самое можно выразить иначе: с возрастом увеличивается бремя хронических болезней. У 95% людей старше 60 лет диагностировано по крайней мере одно хроническое заболевание, например, сердечно-сосудистое заболевание или диабет. У 79% — как минимум два.
Здесь важно различать два показателя: продолжительность жизни (LE - life expectancy) и продолжительность здоровой жизни (HALE - health adjusted life expectancy). Первая отражает общее количество лет, которое ожидается прожить человеку, в то время как вторая показывает, сколько из этих лет будет проведено в хорошем самочувствии. Разница между ними — это годы, потерянные из-за болезней и функциональных ограничений. Этот разрыв с течением времени только увеличивается, поскольку глобальное распространение хронических заболеваний растёт.
Если продолжительность здоровой жизни (HALE) не будет увеличиваться пропорционально общей продолжительности жизни, общество столкнётся не с триумфом долголетия, а с ростом социально-экономического бремени от длительного проживания в состоянии хронической болезни. Единственный устойчивый путь к сокращению этого разрыва — замедление самого процесса старения, причём на уровне всего организма. Если, например, мы успешно снизим смертность от инфаркта, но при этом увеличим распространённость болезни Альцгеймера, мы окажемся в ловушке парадокса: побеждая одну возрастную болезнь, мы лишь даём шанс проявиться другой.
Проблема в том, что увеличение продолжительности жизни без параллельного увеличения её здоровой составляющей не даёт выигрыш в качестве жизни. Люди не уходят из жизни внезапно, будучи полностью здоровыми; они долго и постепенно теряют функции. Поэтому именно замедление системного старения — универсальное, охватывающее все органы и процессы — остаётся единственным стратегически верным способом преодолеть этот всё расширяющийся разрыв.
Вопрос о максимальной продолжительности жизни человека остаётся предметом ожесточённых научных дискуссий. Одни исследователи опираются на закон Гомперца–Мейкхема, согласно которому риск смерти возрастает экспоненциально с течением времени. Другие ссылаются на предел Хейфлика — биологическую гипотезу, утверждающую, что человеческие клетки способны делиться лишь ограниченное число раз, обычно не превышающее 50.
На практике возраст самого долгоживущего из достоверно задокументированных людей — Жанны Кальман — остаётся непревзойдённым с 1997 года: она прожила 122 года. Этот факт часто приводят как аргумент в пользу существования естественного потолка человеческой жизни.
Помимо биологических ограничений, существуют физические — неизбежный износ тканей и органов, кумулятивные повреждения от повторяющихся стрессов, постепенный отказ систем. С этой точки зрения старение можно рассматривать как проявление второго закона термодинамики — необратимого увеличения энтропии в биологических системах.
Всё это делает сам вопрос о наличии абсолютного предела спорным. Даже если в будущем число долгожителей увеличится, это не обязательно будет означать, что они будут жить в добром здравии. Увеличение продолжительности жизни без продления её здоровой составляющей может усугубить дисбаланс между количеством прожитых лет (LE — life expectancy) и их качеством (HALE — healthy life expectancy).
В идеале цель не просто продлить жизнь, но добиться того, чтобы оба показателя совпадали — чтобы человек оставался здоровым вплоть до самого конца. Это задача исключительной сложности, и её решение напрямую зависит от научного прогресса в области геронтологии и биомедицины. Без этого знание о пределах останется академическим, а старение — неумолимым.
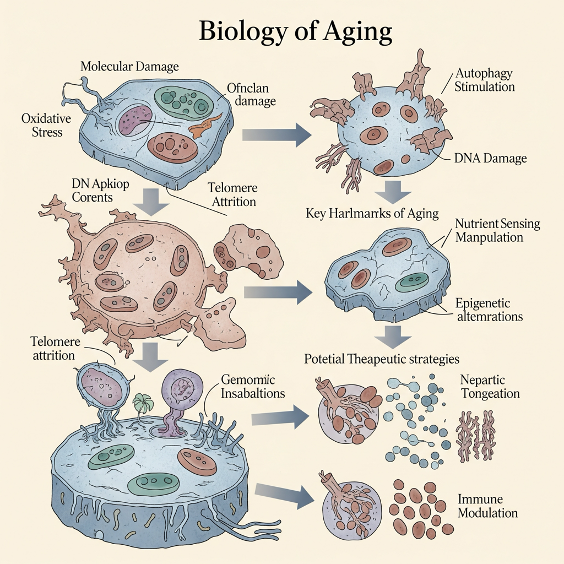
Биология старения
Старение — это сложный биологический процесс, который традиционно рассматривается как накопление молекулярных и клеточных повреждений с течением времени. Эти повреждения подрывают стабильность и функциональность организма, постепенно снижая его способность поддерживать гомеостаз - постоянство внутренней среды организма. Современные представления о биологии старения основываются на выделении ключевых признаков — биологических маркеров, которые не только усиливаются с возрастом, но и, как показывают исследования, активно способствуют старению. Более того, вмешательство в эти процессы способно замедлить или даже частично обратить биологическое старение.
Наиболее авторитетная и широко цитируемая классификация признаков старения была впервые опубликована в 2013 году и получила обновление в 2023 году. За это десятилетие в области геронтологии произошёл значительный прогресс. Первоначально было выделено девять признаков, однако по мере накопления данных их число увеличилось до двенадцати. К основным ранее известным добавились такие важные направления, как хроническое воспаление, состояние микробиома кишечника и механизмы удаления клеточных отходов (см. рис. 1).
Это деление на двенадцать категорий, безусловно, носит определённую степень условности и упрощения. Между признаками существует существенное перекрытие, и они тесно взаимосвязаны. Тем не менее, каждый из них представляет собой потенциальную «точку входа» для разработки терапевтических стратегий, направленных на замедление, приостановку или обращение процессов старения.
Формально признаки классифицируются по трём группам, однако они работают как единая интегративная система. Каждый процесс в настоящее время находится в фокусе внимания исследовательских групп, биотехнологических компаний и клинических инициатив, стремящихся перевести теоретические знания в прикладную медицину.
Далее мы подробно рассмотрим каждый из двенадцати признаков старения — по кругу, условно следуя часовой стрелке. Начнём с геномной нестабильности, лежащей в основе множества возрастных изменений.
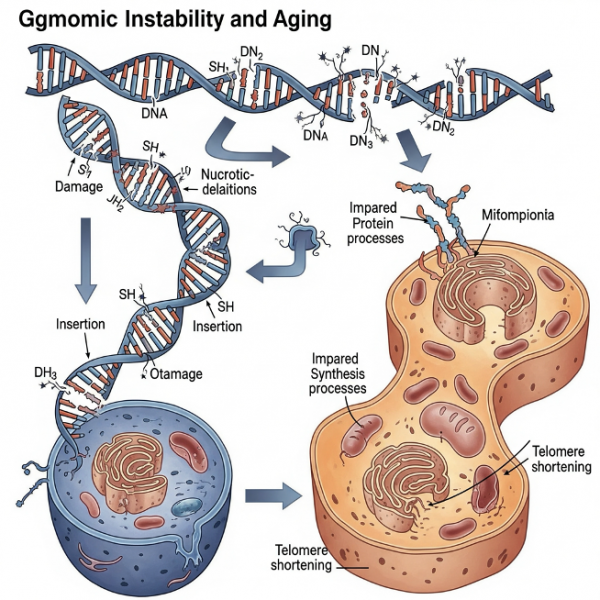
Геномная нестабильность
Изучение генетических вариантов, связанных с долголетием, помогает нам лучше понять, какие гены и молекулярные пути вовлечены в процесс старения. Особенно информативными являются редкие варианты, встречающиеся менее чем у 1% населения, но обладающие высокой силой эффекта и значимой ассоциацией с продолжительностью жизни. Такие варианты выявляются с помощью методов секвенирования — как полного генома (содержащего около трёх миллиардов пар оснований), так и экзома, охватывающего примерно 20 000 генов, кодирующих белковые молекулы.
Более распространённые варианты, присутствующие у более чем 1% населения, обычно обнаруживаются с помощью геномных чипов (массивов). Эти технологии позволили идентифицировать свыше ста однонуклеотидных замен (SNPs), ассоциированных с продолжительностью жизни. В совокупности они могут быть использованы для расчёта полигенной оценки риска, отражающей генетическую предрасположенность к долголетию.
Комбинируя данные о редких и распространённых вариантах, учёные формируют обобщённое представление о наследуемых биологических чертах, влияющих на старение. Однако степень наследуемости долголетия варьирует: по одним из наиболее масштабных оценок (на выборке из 13 миллионов человек) она составляет около 12%, а в других исследованиях — заметно меньше. Эти данные подчеркивают: хотя генетика и играет роль в старении, её вклад ограничен.
Тем не менее, определённые гены стабильно выявляются в исследованиях лиц с исключительным долголетием и в популяционных анализах. Среди них:
· APOE (метаболизм липидов);
· FOXO3 (регуляция ответа на питание);
· IGF-1R (рецептор инсулиноподобного фактора роста-1);
· CETP (липидный обмен);
· CDKN2A/2B (контроль клеточного цикла и старение);
· HLA-гены (иммунные функции);
· BRCA1/BRCA2 и ATM (репарация ДНК);
· TET2 (теломерная регуляция);
· SH2B3, NF-κB (воспалительные процессы);
· CHRNA3, CHRNA5, CELSR2, PSRC1 (межклеточные взаимодействия);
· USP42, TMTC2, CLU (протеостаз и клеточный стресс).
Большинство этих генов относятся к ядерной ДНК, однако и митохондриальные варианты оказывают значительное влияние на старение. Так, мутации в генах mTOR, CPS1, MFN2 и LRPPRC, связанных с митохондриальной функцией и энергетическим обменом, также ассоциированы с продолжительностью жизни.
Таким образом, несмотря на относительную ограниченность генетического вклада, анализ геномной нестабильности даёт нам ценное представление о биологических основах старения и возможных мишенях для терапии.
Все эти данные впечатляют, но что из них действительно может быть использовано на практике? Ответ частично даёт масштабное исследование экзомного секвенирования, проведённое на выборке почти 58 000 исландцев. Это уникальное исследование впервые связало генетическую информацию — всего по 53 функциональным генам — с национальным реестром смертности, продемонстрировав реальное влияние конкретных мутаций на продолжительность жизни.
Результаты оказались весьма наглядными: у 4% участников были выявлены патогенные мутации, способные существенно сократить продолжительность жизни. Например, мутация в гене рецептора липопротеинов низкой плотности (LDLR) была ассоциирована со снижением ожидаемой продолжительности жизни на 6,5 лет. Аналогично, носители мутаций в известных онкогенах — BRCA1, BRCA2 и MSH2 — теряли в среднем около трёх лет жизни. Главное открытие: примерно у одного из 25 человек генетический анализ выявил потенциально значимую мутацию, оказывающую прямое влияние на индивидуальный прогноз по долголетию.
Интересно, что аналогичный уровень — около 4% — был воспроизведён и в других когортах, подтверждая надёжность этих выводов.
К 65 годам в группе носителей патогенных или вероятно патогенных вариантов в онкогенах умерли 10% участников. В контрольной группе без таких мутаций этот же уровень смертности наступал только к 73 годам.
Эти результаты подчеркивают важный момент: большинство генов, которые можно считать «пригодными для действия» (то есть подлежащими медицинскому вмешательству), пока не пересекаются с генами, участвующими в процессах общего старения. Однако среди последних уже сейчас есть потенциальные мишени для будущих терапий — как фармакологических, так и на основе технологий редактирования генома.
Наряду с редкими, но значимыми мутациями, существует полигенный индекс риска, отражающий совокупный вклад распространённых генетических вариантов, ассоциированных с долголетием. Такой индекс был рассчитан для почти 700 000 человек из различных этнических групп, включая отдельную выборку в рамках UKBiobank.
В этих анализах были выделены общие генетические варианты в ключевых областях:
· LPA — гены липидного обмена, по которым уже разрабатываются препараты;
· TP53 — главный страж генома и один из главных онкогенов;
· и многие другие, связанные с риском сердечно-сосудистых заболеваний и онкологии.
Наличие полигенного индекса риска открывает перспективы для более точного прогноза продолжительности жизни, а также для оценки относительного вклада генетики и факторов образа жизни. По мере развития персонализированной медицины такие подходы будут становиться всё более актуальными — как инструмент профилактики, диагностики и индивидуализированного вмешательства.
Всё, что до сих пор обсуждалось в контексте геномики, касалось зародышевой ДНК — той, с которой мы приходим в мир. Однако существует иная, не менее важная категория — соматические мутации, возникающие уже в течение жизни, в клетках тела, а не в половых клетках. Эти мутации накапливаются со временем, и именно они делают каждого из нас уникальной «мозаикой» из клеток с разным генетическим составом.
Благодаря технологиям секвенирования отдельных клеток мы узнали, насколько генетически неоднородны наши ткани. По мере старения количество ДНК-повреждений в клетках возрастает, и генетический профиль внутри одного организма становится всё менее однородным. Более того, на этот процесс влияет не только возраст, но и факторы внешней среды — например, воздействие ультрафиолетового излучения или токсичных химических веществ, вызывающих нестабильность генома. Речь идёт не только о точечных мутациях — изменения могут затрагивать целые участки ДНК, включая активацию так называемых «прыгающих генов» — транспозонов, способных менять своё положение в геноме и нарушать его стабильность.
Особую роль играют соматические мутации в стволовых клетках, поскольку именно они закладывают основу для обновления тканей. Их накопление может менять траекторию старения — от ухудшения восстановления до повышения риска злокачественных новообразований.
Один из способов оценить значимость конкретных генов в старении — проверить, насколько они сохраняются в процессе эволюции. Многие гены и сигнальные пути, связанные с долголетием у человека, имеют ортологов у других видов — от червей до млекопитающих. Это особенно поразительно, учитывая значительные различия в максимальной продолжительности жизни между видами (см. рис. 2).
Интересным исключением из привычных закономерностей является так называемый парадокс Пето: крупные и долгоживущие млекопитающие накапливают соматические мутации медленнее, чем мелкие. Это может указывать на эволюционно сформировавшуюся защиту от рака — медленное накопление мутаций в сочетании с увеличенным числом клеток снижает риск злокачественных трансформаций. В некоторых случаях, как показывают межвидовые сравнения, меньшие животные при этом демонстрируют большую продолжительность жизни, что поднимает новые вопросы о соотношении массы тела, клеточного обновления и скорости старения.
Одним из наиболее интригующих примеров является черепаха — животное, демонстрирующее в двадцать раз более медленное старение, чем млекопитающие, и вдвое — по сравнению с человеком или птицами. Схожий интерес вызывает старение собак: существует крупный международный проект Dog Aging Project, а в Великобритании активно работает инициатива UK Dogs Trust, отслеживающая влияние генетики, диеты и образа жизни на старение у собак.
Но даже черепахи не могут сравниться с удивительным феноменом биологического бессмертия, демонстрируемого медузой Turritopsis dohrnii. Это единственный известный вид, способный к многократной омоложающей трансформации после полового размножения. Полногеномное секвенирование этой «бессмертной медузы» выявило вариации в генах, ассоциированных почти со всеми известными признаками старения: от нестабильности генома, нарушений теломер и митохондриальной дисфункции до истощения стволовых клеток, ухудшения межклеточной коммуникации и клеточного старения.
Таким образом, соматические мутации становятся не просто биологическим побочным эффектом возраста, но ключевым звеном в понимании индивидуальной траектории старения — и, возможно, точкой вмешательства в будущем.
Теломеры: баланс на грани
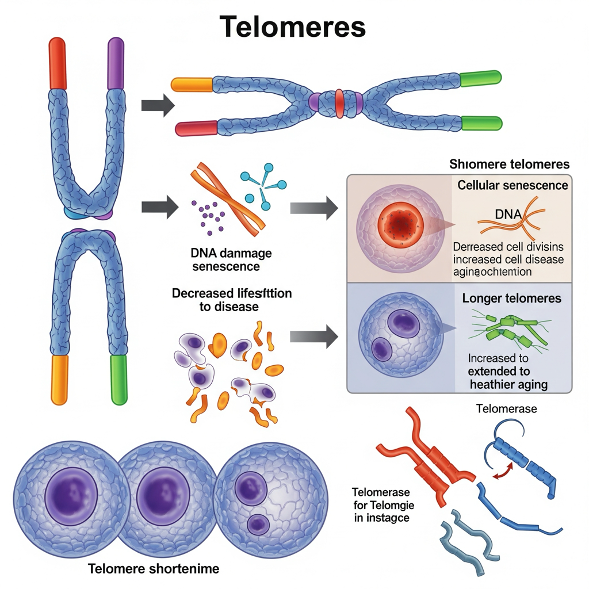
Теломеры — это повторяющиеся участки ДНК на концах хромосом, выполняющие роль защитных «колпачков». На протяжении всей жизни они постепенно укорачиваются в процессе клеточного деления — это часть естественного механизма старения, универсального для всех хромосом человека. Когда теломеры становятся слишком короткими, клетка теряет способность к делению и либо входит в состояние покоя, либо запускает апоптоз (самоуничтожение). Однако теломеры — это история, требующая деликатного баланса, настоящая «ситуация Златовласки»: слишком длинные — опасны, слишком короткие — тоже.
Длинные теломеры, особенно при их избыточной длине относительно возраста, повышают риск развития некоторых злокачественных опухолей. Например, при меланоме, ряде солидных опухолей и других формах рака наблюдается более высокая частота встречаемости у людей с удлинёнными теломерами. Причина — усиленная способность клеток к делению, что в сочетании с нестабильностью генома способствует накоплению мутаций. Иными словами, продолжительный «жизненный путь» клетки даёт ей больше времени для ошибок.
С другой стороны, чрезмерно короткие теломеры связаны с широким спектром возраст-ассоциированных заболеваний. Существуют наследственные синдромы, характеризующиеся патологическим укорочением теломер, которые манифестируют во взрослом возрасте. Среди них — преждевременное поседение, идиопатический лёгочный фиброз и Т-клеточный иммунодефицит. Последний увеличивает предрасположенность к гематологическим злокачественным заболеваниям, включая миелодиспластический синдром и острый миелобластный лейкоз.
Обнадёживающие результаты продемонстрированы в доклинических моделях. В частности, генная терапия с активацией теломеразы (фермента, поддерживающего длину теломер) показала эффективность в подавлении лёгочного фиброза у мышей. Недавние исследования активаторов теломеразы — таких как обратная транскриптаза — показали, что их применение может удлинять теломеры, ослаблять признаки старения тканей и снижать воспаление в мозге — при этом без индукции рака в экспериментальной модели.
Короткие теломеры также играют роль в развитии клонального гемопоэза неопределённого потенциала (CHIP) — состояния, при котором стволовые клетки крови приобретают мутации и образуют клоны. С возрастом CHIP становится всё более распространённым и ассоциируется с повышенным риском сердечно-сосудистых заболеваний, тромбозов и нарушений функции печени. Особенно часто встречается мутация в гене DNMT3A, который участвует в регуляции длины теломер, что подчёркивает тесную связь между теломерной динамикой и клональными мутациями.
Механизмы риска при CHIP, по всей видимости, связаны с хроническим воспалением — явлением, которое получило название «инфламмация» (от англ. inflammaging). Экспериментальные модели подтверждают, что мутации в кроветворных клетках усиливают провоспалительный фон.
Сегодня более 10% людей старше 70 лет имеют CHIP. И хотя ранее в терминологии подчеркивался «неопределённый потенциал», становится всё более очевидным, что это состояние несёт конкретные и значимые риски. Всё указывает на то, что его следует исключить из категории неопределённостей. CHIP должен входить в обязательную оценку риска у пожилых людей — наряду с другими биомаркерами старения, в рамках многослойного персонализированного анализа.
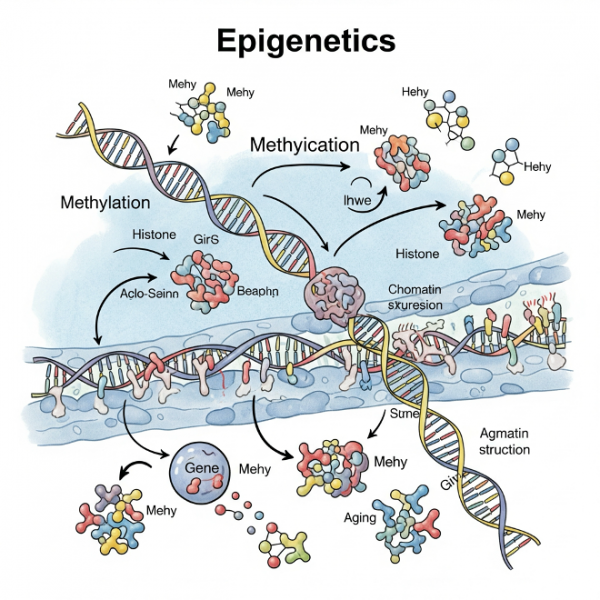
Эпигенетика: регуляторная архитектура старения
Эпигенетика — это наука о том, как трёхмерная упаковка ДНК внутри ядра регулирует активность генов без изменения самой последовательности нуклеотидов. Основные элементы этой системы включают метилирование ДНК, модификации гистонов и структурную организацию хроматина. Вместе они формируют динамическую архитектуру, способную «включать» и «выключать» гены в зависимости от возраста, среды и физиологических условий.
С возрастом происходят закономерные эпигенетические изменения. Один из важнейших процессов — добавление метильных групп к цитозиновым основаниям ДНК, особенно в участках, известных как CpG-островки. Этот процесс называется метилированием ДНК и, как правило, приводит к подавлению экспрессии соответствующих генов. Параллельно происходят изменения гистонов — белков, на которые наматывается ДНК: их ацетилирование обычно активирует транскрипцию. Хроматин — структурный комплекс ДНК и белков — также подвергается ремоделированию, которое может ослаблять или усиливать доступ к определённым участкам генома.
Эпигенетика играет в старении двунаправленную роль: с одной стороны, она регулирует возрастные изменения, а с другой — сама подвергается влиянию старения. Принимая во внимание, что у человека насчитывается около 20 000 активных генов, большинство из которых может быть затронуто метилированием, гистон-модификациями и другими эпигенетическими механизмами (включая некодирующие РНК), становится очевидным, что эпигеном пересекается почти со всеми из 12 ключевых признаков старения.
Среди всех эпигенетических параметров метилирование ДНК на сегодняшний день наиболее точно поддаётся количественному измерению. Именно оно лежит в основе создания так называемых эпигенетических часов — инструментов, позволяющих оценивать биологический возраст организма. Эти часы измеряют характер и уровень метилирования в определённых участках ДНК (например, в клетках крови), сопоставляя биологический возраст с хронологическим. Если биологический возраст превышает фактический — это индикатор ускоренного старения.
Первое подтверждение эффективности эпигенетических часов появилось в 2011 году, и с тех пор они непрерывно совершенствуются. Современные модели становятся всё более точными, позволяя отслеживать динамику старения, прогнозировать возрастные заболевания и даже оценивать потенциальный эффект омолаживающих вмешательств.
Значимость эпигенетических часов выходит далеко за пределы человеческой биологии. Недавние работы показали, что максимальная продолжительность жизни у 348 видов млекопитающих, включая человека, может быть предсказана с помощью эпигенетических маркеров. Этот вывод был подкреплён с использованием метода менделевской рандомизации, который применяли к данным о метилировании ДНК, что позволило установить причинно-следственную связь между эпигенетическим профилем и продолжительностью жизни.
Таким образом, эпигенетика — это не просто фоновая система управления экспрессией генов. Она стала одним из ключевых полей биомедицинских исследований старения, открывающим путь к диагностике, мониторингу и, возможно, целенаправленному вмешательству в биологический возраст.
Прорыв в понимании эпигенетических механизмов омоложения принадлежит выдающемуся учёному Хуану Карлосу Изписуэ Бельмонте. Ранее он работал в знаменитом Институте Солка, а затем присоединился к биотехнологической компании Altos Labs — одному из наиболее амбициозных проектов в области продления жизни. Бельмонте внёс ключевой вклад в расшифровку того, как эпигенетические изменения могут не просто влиять на клеточные функции, но и омолаживать клетки, ткани и, возможно, целые организмы.
В центре его исследований — использование четырёх транскрипционных факторов, известных как факторы Яманаки: Oct3/4, Klf4, Sox2 и c-Myc (сокращённо OKSM). Эти белки названы в честь японского биолога Синъи Яманаки, который в 2012 году получил Нобелевскую премию за открытие возможности перепрограммирования взрослой соматической клетки в индуцированную плюрипотентную стволовую клетку (иПСК). Полное перепрограммирование стирает эпигенетические метки клетки, возвращая её в первозданное «стволовое» состояние, утратившее функциональную идентичность.
Однако Бельмонте и его команда впервые применили частичное перепрограммирование, при котором клетки не теряют своей специализации, но при этом избавляются от возрастных эпигенетических следов. Например, старая клетка сердечной мышцы под воздействием OKSM становилась моложе, сохраняя при этом свою специфическую функцию кардиомиоцита. Такой подход позволил продлить продолжительность жизни и улучшить здоровье преждевременно стареющих мышей, открыв путь к потенциальным терапиям старения.
Ключевая трудность в реализации этой стратегии заключается в точной регуляции степени перепрограммирования. Если воздействие OKSM оказывается слишком продолжительным или интенсивным, клетка может утратить идентичность и трансформироваться в опухолевую. Поэтому одной из перспективных тактик стало ограниченное во времени экспонирование этих факторов — своего рода «транзиентный эпигенетический импульс», при котором эпигенетическая «ручка громкости» поворачивается ровно настолько, чтобы восстановить моложавый эпигенетический профиль, но не дестабилизировать клеточную спецификацию.
Таким образом, частичное перепрограммирование становится не просто экзотической лабораторной техникой, а многообещающим подходом к биологическому омоложению, в основе которого лежит тонкая настройка эпигенетического ландшафта клеток.
Поддержание протеостаза и клеточная утилизация: борьба с внутренним мусором
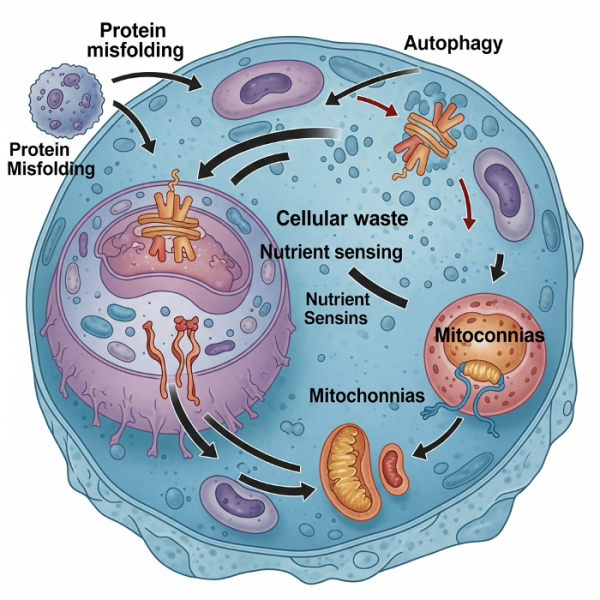
Один из ключевых механизмов, обеспечивающих здоровье клетки и долголетие организма — это протеостаз, то есть поддержание стабильности и функциональности белков. С возрастом эта система даёт сбои, что приводит к неправильному сворачиванию и агрегации белков — процессам, лежащим в основе целого ряда патологий. Типичный пример — катаракта, вызванная скоплением дефектных белков в хрусталике. На более системном уровне нарушение протеостаза связано с нейродегенеративными заболеваниями, включая болезнь Паркинсона и болезнь Альцгеймера.
Клетка обладает изощрённым механизмом распознавания и удаления повреждённых белков. Один из ключевых путей — убиквитин-протеасомная система, при которой дефектные белки маркируются убиквитином и направляются на переработку в протеасомах — специализированных структурах, аналогичных молекулярным шредерам. Однако это лишь один аспект более широкой системы утилизации клеточных отходов.
Центральную роль в этом процессе играют лизосомы — внутриклеточные органеллы, выполняющие функцию «мусорных баков», в которых разрушаются повреждённые белки и митохондрии. Транспортировку этого мусора осуществляют аутофагосомы — пузырьки в цитоплазме, которые сливаются с лизосомами, формируя замкнутую систему очистки. Вся эта система называется аутофагией и жизненно важна для поддержания клеточного здоровья.
С возрастом эффективность аутофагии снижается, что приводит к накоплению клеточного мусора, разрыву лизосом и митохондрий, а также к усилению хронического воспаления и окислительного стресса — факторов, способствующих старению и развитию хронических заболеваний.
Интересно, что активация аутофагии демонстрирует многообещающие эффекты в животных моделях долголетия. Такие препараты, как метформин и рапамицин, стимулируют клеточную уборку и ассоциированы с продлением жизни у модельных организмов. Более того, ограничение калорийности и регулярная физическая активность также усиливают аутофагические процессы, выступая в роли естественных регуляторов внутриклеточной гигиены.
Таким образом, восстановление и поддержание эффективного протеостаза и аутофагии становятся ключевыми стратегиями в борьбе со старением и поддержании функционального долголетия.
Сенсорные пути восприятия питательных веществ и митохондриальная дисфункция
В центральной оси процессов старения — механизмы, с помощью которых клетки ощущают и перерабатывают питательные вещества. В этой системе участвуют ключевые молекулы: гормон роста, глюкоза, инсулин, инсулиноподобный фактор роста-1 (IGF-1) и его рецептор IGF-1R, а также аминокислоты и другие компоненты питательной сигнальной сети, регулирующей широчайший спектр клеточных функций. Центральным объектом их воздействия являются митохондрии — энергетические станции клетки, обеспечивающие её жизнеспособность и устойчивость к повреждениям.
В научных исследованиях старения значительное внимание уделяется ограничению калорийности. В ряде экспериментов на дрожжах, грызунах и плодовых мушках сокращение суточного калоража примерно на 40% стабильно приводило к продлению жизни. Однако для перевода этих данных в контекст человека особенно интересны результаты, полученные на нечеловеческих приматах: при более мягком снижении калорийности — всего на 14% — в течение двух лет наблюдались значительные улучшения митохондриальной функции, снижение системного воспаления и признаки замедленного старения иммунной системы.
Подобные результаты были воспроизведены и у людей. В одном из крупнейших клинических экспериментов участие более 1700 человек показало, что двухлетнее умеренное (на 12%) ограничение калорийности привело к значимому снижению биологического возраста — в ряде случаев превышающему эффект от всех других известных немедикаментозных вмешательств.
Помимо дефицита калорий, существует ряд стратегий, влияющих на сенсорные пути восприятия топлива клеткой. Среди них:
· Ингибирование IGF-1 и гормона роста,
· Кетогенная диета,
· Активация сиртуинов,
· Ингибиторы mTOR (механистической мишени рапамицина).
Эти подходы демонстрируют значительные эффекты на митохондриальный биогенез, активацию аутофагии, снижение воспаления и замедление клеточного старения.
Современные исследования также акцентируют внимание на митохондриальных везикулах — микроскопических пузырьках, транспортирующих молекулы от митохондрий к лизосомам и другим органеллам. Их функциональность всё чаще рассматривается как независимый маркёр клеточного старения, поскольку нарушения в этих внутриклеточных «логистических» путях ведут к энергетическим сбоям, накоплению повреждений и нарушению гомеостаза.
Суть проста: если клетка не способна эффективно чувствовать, усваивать и перерабатывать питательные вещества, она теряет способность к регенерации и адаптации. Именно поэтому метаболическая гибкость и митохондриальная эффективность являются центральными факторами в стратегии замедления старения и продления здоровья.
Стареющие клетки: ключевые участники патологии и мишени для терапии
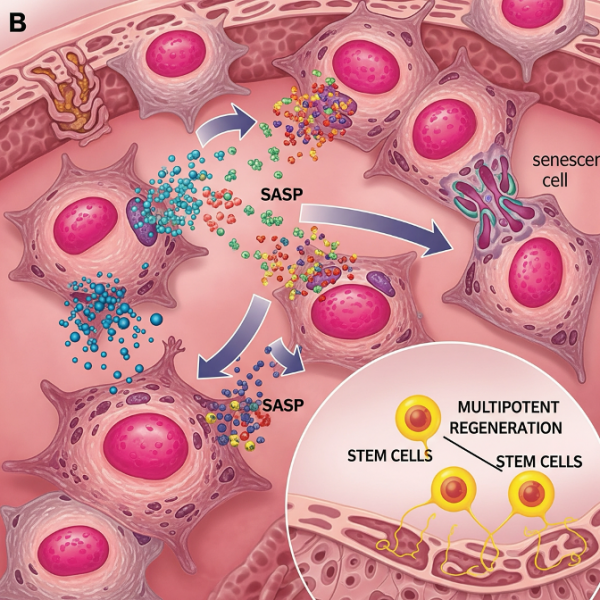
В отличие от молодых и функционально активных клеток, стареющие клетки обладают рядом характерных признаков. Среди них — увеличенный размер, повышенное содержание митохондрий и лизосом, утрата способности к делению, укорочение теломер, а также высокая активность фермента бета-галактозидазы. Вместе с этим меняется их секреторный профиль, что оказывает влияние на окружающие ткани. Однако не каждая старая клетка является по определению стареющей: старение клеток представляет собой биологический сдвиг, при котором клетка утрачивает свои прежние функции и приобретает новые, часто деструктивные свойства. Более того, проявления клеточного старения варьируются в зависимости от типа ткани и контекста, что делает невозможным их простую классификацию.
Ключевая проблема заключается в накоплении таких клеток в организме с возрастом. Это не просто пассивные участники процесса — они становятся активными возбудителями хронического воспаления. Секретируя провоспалительные цитокины, хемокины и ферменты, стареющие клетки формируют так называемый сенесцентный секреторный фенотип (SASP). Это воспалительное окружение, в свою очередь, индуцирует старение у соседних клеток, создавая замкнутый круг дегенерации.
Стареющие клетки играют центральную роль в патогенезе сердечно-сосудистых, неврологических, почечных, печёночных, опорно-двигательных и эндокринных заболеваний. В иммунной системе старение приводит к снижению иммунной функции, ухудшению выработки антител и повышенной восприимчивости к инфекциям. Особенно убедительны данные о старении нейронов как о ведущем механизме нейродегенерации и когнитивного упадка.
Вместе с тем, не все стареющие клетки следует считать патологическими. В ряде случаев они участвуют в физиологических процессах, включая секрецию инсулина бета-клетками поджелудочной железы, регенерацию тканей и ограничение пролиферации потенциально злокачественных клеток. Эти различия подчеркивают важность контекста и клеточной специфичности при оценке роли стареющих клеток.
Тем не менее, многочисленные эксперименты на животных моделях показывают, что селективное устранение стареющих клеток способствует продлению жизни и улучшению здоровья у мышей. Это стимулировало активные разработки сенолитических препаратов — веществ, способных избирательно уничтожать или деактивировать стареющие клетки.
Оценка таких препаратов и их возможностей будет подробно рассмотрена в отдельном разделе, посвящённом антивозрастной фармакологии и клиническим испытаниям. Старение клеток — это не только фундаментальная биологическая проблема, но и многообещающая терапевтическая мишень в борьбе за активное долголетие.
Истощение стволовых клеток: истоки регенеративной уязвимости
Взрослые стволовые клетки представляют собой фундаментальные элементы поддержания тканевого гомеостаза и регенерации. Они различаются по типу ткани, в которой локализуются: например, гемопоэтические стволовые клетки (ГСК) обитают в костном мозге и участвуют в обновлении клеток крови, тогда как мышечные сателлитные клетки (МСК) отвечают за восстановление скелетной мускулатуры. Независимо от локализации, все стволовые клетки объединяет уникальное свойство — способность к самообновлению и дифференцировке, обеспечивающее долгосрочное функционирование органов и тканей.
Однако именно их длительное существование и пролонгированная активность делают их особенно уязвимыми к накапливающимся с возрастом повреждениям. Постепенное истощение пулов стволовых клеток, снижение их способности к пролиферации и регенерации — это один из ключевых механизмов возрастной дегенерации.
Классическим примером является саркопения — потеря мышечной массы и силы у пожилых людей, обусловленная нарушением функции МСК. Хроническая активация провоспалительных сигнальных путей угнетает активность этих клеток, ограничивая их способность к восстановлению повреждённой мышечной ткани. Однако физическая активность и тренировки обладают потенциалом частичного омоложения МСК, что подтверждено экспериментально.
Аналогичная динамика наблюдается и для гемопоэтических стволовых клеток. С возрастом они теряют «пригодность» — способность к эффективному формированию сбалансированного пула иммунных клеток. Интересно, что в экспериментах на животных таргетированное удаление повреждённых или истощённых ГСК с помощью специфического антитела привело к омоложению иммунной системы. Это подчёркивает двойственную роль истощения: оно не просто сопровождает старение, но способствует его ускорению.
Таким образом, поддержание функциональности стволовых клеток — будь то за счёт омоложения микросреды, модуляции воспаления или терапевтического восстановления пулов — представляет собой одно из самых перспективных направлений в науке о продлении активного долголетия.
Межклеточная и межорганная коммуникация: распад сигналов и новые векторы терапии
С возрастом нарушается внутри- и межтканевая коммуникация клеток, что приводит к системным изменениям в работе органов и тканей. Одним из наиболее ярких проявлений этой дисрегуляции является сенесцентный ассоциированный секреторный фенотип (SASP) — комплекс факторов, выделяемых стареющими клетками. В его состав входят цитокины, хемокины, ферменты, ремоделирующие внеклеточный матрикс, а также факторы роста, влияющие на окружающие клетки.
Стареющие иммунные клетки активно участвуют в этой сигнальной сети, передавая воспалительные импульсы по всему организму. Например, воспаление дёсен — локальное проявление иммунного ответа — было связано с повышенным риском фибрилляции предсердий, подчеркивая, как локальные нарушения влияют на системное здоровье. В экспериментальных моделях было показано, что стрессированные митохондрии микроглии (клеток иммунной системы мозга) могут отправлять сигналы, стимулирующие восстановительные процессы в других органах.
Продвинутая методология, например платформа CellChat, позволила исследователям создать атлас старения мышечных клеток, визуализируя тысячи путей межклеточной коммуникации. С возрастом некоторые сигналы, особенно те, что связаны с воспалением, нарушением регуляции факторов роста и избыточным отложением внеклеточного матрикса, усиливаются вдвое, способствуя мышечной атрофии.
Не менее важна и межорганная коммуникация. Последние исследования показали, что ткани выделяют десятки и сотни молекулярных сигналов, критически влияющих на здоровье всего организма. Так, мышечная ткань выделяет около 600 сигналов, а жировая — более 100, воздействуя не только через кровь, но и через нейрогуморальные механизмы.
Яркий пример — усиление связи между гипоталамусом и жировой тканью в модели на мышах, что привело к повышенной физической активности и увеличению продолжительности жизни. Этот эффект осуществлялся через симпатическую нервную систему и секрецию жировыми клетками внеклеточной формы никотинамидфосфорибозилтрансферазы (eNAMPT). Вливание внеклеточных везикул, выделенных у молодых животных, пожилым мышам приводило к улучшению системных функций и продлению жизни.
Костная ткань также участвует в межорганной сигнализации: гормон остеокальцин, выделяемый костями, стимулирует секрецию инсулина печенью, улучшает захват глюкозы мышцами и даже поддерживает когнитивные функции.
Наконец, сердце проявляет эффект так называемой стрессовой памяти: после перенесённого повреждения оно вызывает эпигенетическую репрограммировку гемопоэтических стволовых клеток, что, в свою очередь, способствует повторным эпизодам сердечной недостаточности и поражению почек и скелетной мускулатуры.
Все эти примеры показывают, насколько сложной и взаимозависимой является биология старения. Нарушения в одной системе могут запускать каскад изменений в других, а модуляция этих цепей может стать ключом к замедлению старения и продлению активной жизни.
Хроническое воспаление, как движущая сила старения
Возраст-ассоциированное хроническое воспаление представляет собой системный воспалительный процесс, усиливающийся с возрастом и существенно варьирующийся у разных людей. Его выраженность измеряется по уровням С-реактивного белка (CRP), интерлейкина-6 (IL-6), фактора некроза опухоли-α (TNF-α), а также по активности латентных вирусных инфекций.
Хроническое воспаление считается одним из центральных механизмов старения, тесно связанных с развитием рака, нейродегенеративных заболеваний, сердечно-сосудистой патологии и метаболических расстройств. Так, в исследованиях на старых мышах было показано, что подавление интерлейкина-11 (IL-11), взаимодействующего с IL-6, приводит к множественным положительным эффектам: улучшению метаболизма, восстановлению мышечной функции, преобразованию белого жира в термогенный бежевый, снижению роста опухолей и значительному увеличению продолжительности жизни. Особенно важно, что препараты, подавляющие IL-11, уже проходят клинические испытания, например, при интерстициальных заболеваниях лёгких, что открывает перспективу их применения и в геронтологической терапии.
Не менее обнадеживающие результаты получены при комбинированном подавлении IL-6 и активированной инфламмасомы NLRP3 — крупного белкового комплекса врожденной иммунной системы. Его активация вызывает выброс IL-1β, IL-6 и других провоспалительных цитокинов. Однако современные низкомолекулярные ингибиторы позволяют эффективно блокировать ключевые звенья этого пути, снижая уровень воспаления и потенциально замедляя старение.
Среди новых мишеней выделяется сигнальный путь cGAS–STING, включающий циклическую GMP-AMP-синтазу (cGAS) и STING (стимулятор интерфероновых генов). Он активируется при утечке митохондриальной ДНК в цитоплазму — тревожном сигнале клеточного повреждения. Блокирование этого пути в экспериментальных моделях приводит к снижению возрастного воспаления в нескольких органах и головном мозге.
Таким образом, воспаление — не просто побочный эффект старения, а одна из его причинных осей, а следовательно, важнейшая точка терапевтического воздействия в попытках замедлить биологическое старение организма.
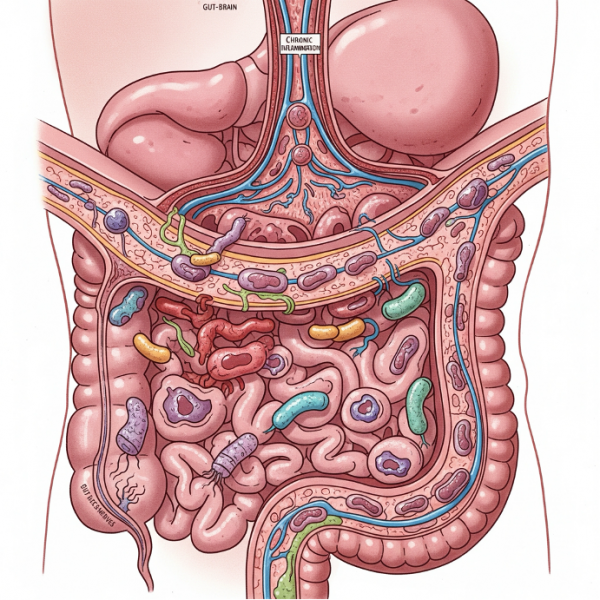
Микробиом кишечника: микроскопический дирижёр старения
Роль кишечного микробиома в регуляции иммунного ответа давно признана, но его значение выходит далеко за пределы одной лишь иммунной функции — сегодня мы знаем, что микробиота активно участвует в процессе старения организма. Совокупность микробных сообществ в кишечнике способна модулировать метаболизм, воспалительные процессы, работу мозга и даже продолжительность жизни.
Профили микробиоты у долгожителей часто демонстрируют «юношеские» бактериальные и вирусные паттерны, отличающиеся от микробиома у их сверстников. Это находит подтверждение в крупном исследовании с участием более 9 000 человек в возрасте от 40 до 93 лет, где установлена чёткая связь между составом кишечной флоры и риском сердечно-сосудистых заболеваний при долгосрочном наблюдении.
В отдельной когорте из более чем 1 800 пожилых людей были обнаружены определённые виды бактерий, ассоциированные с синдромом старческой слабости (frailty) и неблагоприятными клиническими исходами в течение следующих двух лет. Эти микробные паттерны предсказывали не только функциональные нарушения, но и скорость старения.
Экспериментальные модели подтверждают причинную связь: трансплантация фекальной микробиоты от молодых мышей к старым приводила к улучшению когнитивных функций, тогда как обратная трансплантация — от старых к молодым — вызывала системное воспаление и инфламмацию, ускоряя старение.
Таким образом, микробиом кишечника можно рассматривать как биологический интерфейс между внешней средой и процессами старения. Его коррекция — будь то через питание, пробиотики, пребиотики или трансплантацию микробиоты — представляет собой перспективное направление в стратегии замедления возрастных изменений.
Теперь, когда мы рассмотрели все двенадцать ключевых признаков старения, настало время перейти к биомаркерам, позволяющим количественно оценивать биологический возраст и отслеживать эффективность геронтологических интервенций.
Биомаркеры старения
Первые достоверные эпигенетические предикторы биологического возраста появились в 2011 году. Тогда учёные продемонстрировали, что метилирование ДНК в слюне может с высокой точностью отражать хронологический возраст — с погрешностью всего в пять лет. Исследование проводилось на 34 парах близнецов, в рамках которого было проанализировано 88 CpG-сайтов — участков ДНК, где метильные группы присоединяются к цитозиновым нуклеотидам, подавляя активность генов.
Через несколько лет были представлены два прорывных инструмента, известных как эпигенетические часы. Один был разработан Грегори Ханнумом и его командой, опираясь на 71 CpG-сайт в образцах крови 19 человек. Другой — Стивом Хорватом, который использовал 353 CpG-сайта из различных тканей для создания своих DNAmAge-часов. Эти часы позволили впервые проследить динамику метилирования с возрастом, которая, как было показано, ускоряется в ранние годы жизни, а затем стабилизируется.
С тех пор эпигенетические часы претерпели значительные усовершенствования. Сегодня три основные модели активно используются в научных и клинических исследованиях:
· DNAm PhenoAge — сочетает данные о метилировании с клиническими показателями, такими как уровни альбумина, креатинина, глюкозы, С-реактивного белка, а также с лейкоцитарной формулой.
· DNAm GrimAge — фокусируется на прогностике риска смертности и возрастных заболеваний.
· DunedinPACE — оценивает скорость биологического старения.
Особенно тревожный сигнал поступил из анализа почти 150 000 участников UKBiobank. Исследование показало, что люди, родившиеся после 1965 года, имеют более высокий PhenoAge, то есть их биологический возраст превышает хронологический. Это означает, что, несмотря на все достижения медицины и образа жизни, клетки у новых поколений стареют быстрее.
Этот неожиданный вывод заставил учёных задуматься о возможной связи между ускоренным клеточным старением и ростом заболеваемости онкологическими заболеваниями у молодых людей. Таким образом, эпигенетические часы становятся не только инструментом оценки биологического возраста, но и мощным предиктором общественного здоровья.
Эпигенетические часы нового поколения: PhenoAge, GrimAge и DunedinPACE
Среди множества биомаркеров старения особое место занимают усовершенствованные эпигенетические часы, продемонстрировавшие высокую прогностическую ценность не только в оценке биологического возраста, но и в предсказании конкретных заболеваний и риска смертности.
PhenoAge, помимо своей базовой функции определения биологического возраста, зарекомендовал себя как эффективный предиктор кардиометаболических заболеваний и летальных исходов. Он учитывает как метилирование ДНК, так и клинико-лабораторные параметры, отражающие физиологическое состояние организма.
Ещё более продвинутой моделью стали часы DNAm GrimAge, представленная в работе под названием «GrimAge убедительно предсказывает продолжительность жизни и здоровья». Эта модель использует двухэтапный подход, объединяя несколько биомаркеров крови, включая белки, связанные с возрастом, и поведенческие параметры, такие как количество выкуренных пачек-лет. Такая интеграция позволяет чётко дифференцировать темпы старения, выделяя «быстро стареющих» и «замедленно стареющих» индивидов.
Третьим значимым инструментом стали часы DunedinPACE (Pace of Aging Computedfrom the Epigenome), которые уникальны тем, что построены на основе продольных данных, собранных в течение десятилетий от когорты людей, родившихся в одном и том же году. В отличие от перекрёстных исследований, таких как UK Biobank, DunedinPACE позволяет отслеживать реальные темпы старения во времени, а не только моментные срезы.
Эпигенетические часы стали также инструментом оценки популяционного воздействия внешних факторов. Например, они позволили выявить ускорение биологического старения после перенесённой инфекции COVID-19 и у активных курильщиков. Напротив, физическая активность и растительная диета ассоциировались с замедлением эпигенетического старения. Даже тяжёлые эмоциональные события, такие как утрата близкого человека, отражаются в ускоренном «ходе» этих часов.
Однако между различными моделями эпигенетических часов имеются отличия — как по прогностической точности, так и по чувствительности к вмешательствам. Это вызвало необходимость проведения сравнительных бенчмаркинговых исследований, которые уже запущены и должны помочь в стандартизации подходов к оценке биологического возраста в клинической и исследовательской практике.
Новое поколение «часов» старения: мультиомика и искусственный интеллект
Помимо эпигенетических, сегодня существует множество других типов так называемых биологических часов, разработанных на основе данных различных «омических» уровней — включая метаболомику, транскриптомику, протеомику, липидомику и гликомику (измерение сахарных модификаций белков). Особенно заметные успехи были достигнуты в области протеомных часов старения.
Эти модели, основанные на анализе белков плазмы крови, прошли обширную валидацию в трёх национальных биобанках — Великобритании, Финляндии и Китая. Протеомные часы продемонстрировали надежную прогностическую ценность в отношении 18 различных хронических заболеваний, общей смертности и признаков возрастного снижения, включая когнитивные нарушения. Это масштабное исследование подтвердило, что белковые маркеры крови станут ключевыми индикаторами функционального возраста в будущем.
Важным направлением стали часы, построенные на воспалительных маркерах, такие как iAge, отражающие общее воспалительное состояние организма. Наряду с ними используются часы IMM-AGE, которые характеризуют возрастные изменения в иммунной системе. Другие подходы включают митотические часы клеточного деления, основанные на паттернах гипо- и гиперметилирования ДНК, ассоциированных с онкогенезом и общей скоростью клеточной пролиферации.
Современные технологии искусственного интеллекта расширили границы возможного. Мультимодальная AI-модель, проанализировавшая изображения лица, языка и сетчатки глаз более чем у 11 000 здоровых людей, продемонстрировала высокую точность оценки биологического возраста — без использования лабораторных тестов. Другая передовая система, ENABL (Explained Biological Age), интегрировала генетические данные, протеомные маркеры и клиническую историю в трёх разнообразных популяциях. Эта модель показала лучшую интерпретируемость и прогностическую точность, чем уже устоявшиеся стандарты вроде PhenoAge и GrimAge.
Особого внимания заслуживает технология EyeAge — система, основанная на алгоритмах глубокого обучения, которая анализирует изображения сетчатки и может точнее предсказывать возраст, чем эпигенетические часы, как было подтверждено в трёх независимых когортах.
Тем не менее, большинство существующих моделей сталкиваются с общей проблемой: отсутствием чёткого разграничения между нормальным старением и патологическим. Хронические заболевания «размывают» биологический возраст, снижая точность предсказаний. Одна из немногих моделей, специально разработанных для отделения здорового старения от возрастной патологии, выявила важные лабораторные маркеры: низкий уровень нейтрофилов и пониженная щелочная фосфатаза в возрасте 50–60 лет ассоциировались с высокой вероятностью дожить до 70 лет и старше в добром здравии.
Этот подход — движение к персонализированной оценке возраста, учитывающей не только биологические процессы, но и вероятность благополучного старения — представляет собой один из самых перспективных рубежей геронтологической науки.

Органные и протеомные часы: новые горизонты биологического возраста
Мы живём в уникальную эпоху, когда стало возможным одновременно анализировать тысячи плазменных белков у тысяч людей различного возраста. Эти данные открыли путь не только к созданию протеомных часов старения, но и к разработке органоспецифичных биологических часов. При построении протеомных часов на основе популяционных данных были выявлены три ключевых возрастных пика в изменениях белкового профиля на протяжении жизни человека (см. рис. 3), каждый из которых характеризовался своим набором белков.
Особенно примечателен второй пик, возникающий в среднем возрасте — он оказался связан с повышенным риском сердечно-сосудистых заболеваний и болезни Альцгеймера. Именно так развивается старение: незаметное накопление биологических изменений, сменяющееся резким обострением дисфункции. Протеомные часы, улавливающие эти переходы, могут стать ранними индикаторами надвигающихся сбоев, позволяя вовремя вмешаться.
Однако возникает резонный вопрос: дают ли эти новые часы — за пределами уже устоявшихся эпигенетических — действительно уникальную или дополнительную информацию о старении? На данный момент ответ остаётся неопределённым. Одно из крупных исследований, в котором оценивались геномные, протеомные и метаболомные профили более чем у 3500 человек, но не рассматривалась эпигенетика, не прояснило этот вопрос. Это упущение ограничивает наше понимание перекрёстной ценности различных «омических» слоёв.
Более того, большинство биологических часов создаются на основе популяционных данных, и их применимость к индивидуальному уровню остаётся сомнительной. К тому же, понятие «биологического возраста» всё ещё лишено чёткого определения. Что означает, скажем, «ваш биологический возраст — на десять лет моложе хронологического»? Какие клинические действия следуют из этого? У нас нет доказанных протоколов, основанных на таких оценках, из проспективных клинических испытаний, которые бы подтверждали долгосрочные выгоды от изменения поведения на основе этих данных.
Если, к примеру, человек узнаёт, что его биологический возраст превышает паспортный на несколько лет — приведёт ли это знание к устойчивым изменениям в образе жизни, или же это будет просто повод для тревоги? А если его биологический возраст — ниже, разве это отменяет необходимость в здоровых привычках?
Пока такие часы дают скорее пищу для размышлений, чем чёткие рекомендации, всё, что мы реально можем предложить — это придерживаться проверенных стратегий здорового образа жизни. Назовём это подходом «Lifestyle+»: физическая активность, качественный сон, разнообразная растительная диета, отказ от курения, социальные связи, стресс-менеджмент и регулярные медицинские осмотры. А остальное — пока в будущем.
Это, впрочем, не остановило волну коммерциализации биологических часов. На рынке появились десятки предложений, обещающих измерить «истинный» биологический возраст. Например, компания TruDiagnostic предоставляет результаты DunedinPACE, дополняя их метриками функции иммунных клеток, «физического фитнеса», длины теломер и другими отчётами. GlycanAge предлагает один тест за 348 долларов, а пакет из двух — за 599 долларов. Generation Lab продаёт четыре анализа биологического возраста за 149 долларов в месяц, а также VIP-программу стоимостью 3499 долларов в год. Аналогичные сервисы предоставляют Tally Health, Elysium Health и Novas Labs, предлагая не только диагностические тесты, но и сопутствующие биодобавки, якобы предназначенные для «омоложения».
Однако пока не рекомендуется пользоваться ни одним из этих тестов или препаратов, включая измерения длины теломер и эпигенетических часов, в качестве клинического инструмента. Их научная ценность пока ограничена исследовательскими задачами. Важнейшее ограничение — отсутствие подтверждённых клинических данных из строгих рандомизированных контролируемых испытаний, которые бы демонстрировали, что знание о своём «биологическом возрасте» само по себе приводит к улучшению здоровья или прогнозов выживаемости. Пока эти технологии не прошли достаточную валидацию, они остаются скорее модными аксессуарами эпохи биохакерства, чем инструментами доказательной медицины.
Органные часы: индивидуальный ритм старения
Одна из ключевых проблем использования универсальных биологических часов заключается в их неспособности уловить органоспецифическую природу старения. Одни люди стареют преимущественно по «кардиальному типу» — быстрее других изнашивается сердце. У других на первом плане оказывается старение мозга, почек, мышц или печени.
Важный вклад в эту область сделал Тони Висс-Корай из Стэнфордского университета. Его команда проанализировала почти пять тысяч плазменных белков, ассоциированных с одиннадцатью основными органами, у 5676 человек из пяти независимых когорт, охватывая все стадии жизни. Результаты показали: старение внутренних органов происходит асинхронно и гетерогенно. Каждый орган имеет свой уникальный белковый профиль старения, и у каждого пятого участника было зафиксировано ускоренное старение хотя бы одного органа. Однако только около 2% оказались «многоорганными старейшими» — у них старение происходило ускоренно сразу по нескольким направлениям.
Что особенно важно, разрыв между органным и хронологическим возрастом предсказывал негативные исходы:
· «Старое сердце» ассоциировалось с пятикратным ростом риска сердечной недостаточности.
· Маркеры старения мозга повышали риск болезни Альцгеймера.
· Старение мышц — нарушений походки.
· Старение почек — развития гипертонии и метаболического синдрома.
На иллюстрации (рис. 4, верхняя панель) показано, как эти разрывы коррелировали с смертностью на протяжении 15 лет наблюдения.
Эти результаты были позже подтверждены и расширены в масштабных исследованиях с использованием данных UK Biobank. У 52 898 участников были измерены уровни более трёх тысяч плазменных белков, на основании которых выстроены органные часы и оценено влияние образа жизни и вмешательств.
Ключевые наблюдения:
· Алкоголь ускорял старение мозга, почек и кишечника.
· Курение негативно влияло на все органы, включая мозг, иммунную систему, печень, почки и кишечник.
· Мужчины были биологически старше женщин и старели быстрее по всем органным системам.
· Мюсли, жирная рыба, свежие салаты замедляли старение, тогда как сладкие напитки, белый хлеб и солёные закуски — ускоряли.
Людгер Геоминне и его коллеги из Гарвардской медицинской школы сделали важный вывод:
«Эти данные демонстрируют, что будущие антивозрастные вмешательства должны быть нацелены не только на общий биологический возраст, но и учитывать индивидуальные уязвимые органы. Это открывает путь к по-настоящему персонализированной геронтологической медицине.»
Протеомные органные часы: новые горизонты прогноза и долголетия
Одно из наиболее масштабных и впечатляющих исследований, основанных на данных UK Biobank, включало более 44 000 участников и оценивало состояние одиннадцати органных систем с помощью анализа около трёх тысяч плазменных белков. Результаты подтвердили: каждый орган стареет по-своему, и эти изменения позволяют с высокой точностью предсказать развитие возраст-ассоциированных заболеваний.
Так, например, ускоренное старение мозга почти в два раза увеличивало риск болезни Альцгеймера. Более того, исследование выявило влияние различных вмешательств на биологический возраст органов:
· Курение ускоряло старение большинства систем;
· Физическая активность оказывала защитное действие;
· Заместительная гормональная терапия (ЗГТ) была связана с замедлением старения мозга, иммунной системы, печени и артерий.
Особенно важный вывод: “молодость” мозга и иммунной системы оказалась тесно связана с увеличенной продолжительностью жизни (см. рис. 4, нижняя панель). Напротив, чем больше органов демонстрировали ускоренное старение, тем хуже была общая выживаемость.
В параллельной когорте почти 42 000 человек, плазменные профили на основе 3000 белков позволили точно предсказать развитие более 200 заболеваний — как распространённых, так и редких — на протяжении 10-летнего наблюдения.
Этот высокопроизводительный протеомный подход, объединённый с геномными данными и электронными медицинскими картами, анализировался с использованием алгоритмов машинного обучения. В исследовании более чем 25 000 участников его прогностическая сила была подтверждена для множества заболеваний.
Особое внимание было уделено ранней диагностике деменции:
В исследовании 52 000 здоровых взрослых было выявлено четыре ключевых белка — GFAP, NEFL, GD15 и LTBP2 — которые демонстрировали высокую специфичность для прогноза развития деменции за десятилетие до клинического диагноза.
Другие плазменные маркеры предсказывали и другие возрастные состояния — например, риск перелома бедра, одного из наиболее серьёзных факторов смертности среди пожилых.
Если эти органные часы на основе белков плазмы будут подтверждены в клинических испытаниях как инструмент индивидуального прогноза и мониторинга, их можно будет по праву считать одним из крупнейших достижений в современной геронтологии — не просто как индикатор старения, но как навигационный инструмент для продления здоровья и жизни.
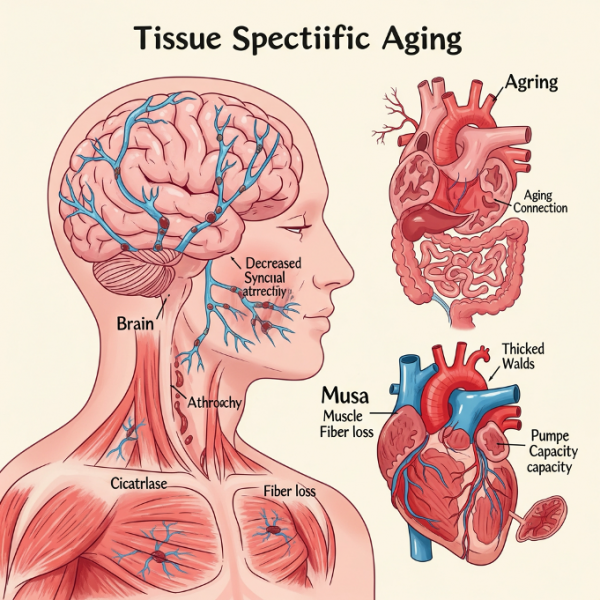
Тканеспецифическое старение
Старение — это процесс, глубоко укоренённый в тканевой специфике. Чтобы понять, почему некоторые люди в возрасте 80 лет и старше обладают исключительным состоянием когнитивных функций и сохраняют ясность ума, исследователи провели всестороннюю оценку, сравнив таких «супервозрастных» с контрольными группами того же возраста. Результаты оказались поразительными: у супервозрастных отмечались увеличенный объём серого вещества, замедленная атрофия мозговой ткани, более высокая моторная скорость, лучшая сохранность микроструктуры белого вещества и отсутствие признаков ухудшения психического здоровья.
Примечательно, что между группами не было обнаружено различий по наличию аллеля APOE4, уровню амилоидных отложений в мозге или по образу жизни. В другом аналогичном исследовании было показано, что мозг супервозрастных по своим параметрам больше напоминал мозг 50–60-летних, а не их сверстников в возрасте 80 лет, при этом их память и когнитивные способности соответствовали гораздо более молодому возрасту.
Эти данные подчеркнули важность структурных различий в мозге и их связь с когнитивной функцией, однако не дали ответа на вопрос, почему некоторые люди стареют медленнее других именно на уровне головного мозга. Особенно интересным стало открытие, что эпигенетические часы, построенные по метилированию тканей мозга (HistoAge), демонстрировали иную траекторию старения по сравнению с классическими эпигенетическими часами Хорвата, рассчитанными на основе общетелесных образцов. Это наглядно подтверждает существование органоспецифических (и тканеспецифических) моделей старения.
Похожие выводы были получены в крупном исследовании, включавшем анализ более 400 омических биомаркеров у свыше 4000 участников, где также было показано: разные органы у одного и того же человека стареют с разной скоростью, что подчёркивает необходимость персонализированного подхода в геронтологии.
Накапливаются доказательства существования так называемого «средневозрастного мозга» — понятия, аналогичного второй волне возрастных изменений в плазменных белках, отмечаемых в среднем возрасте. Именно в этот период, как показывает рисунок 5, происходит перелом в молекулярных и физиологических процессах, связанных со старением. Этот продолжительный промежуток — от 10 до 20 лет до появления симптомов нейродегенеративных заболеваний — представляет собой ценное терапевтическое окно. Это время, когда возможно модулировать факторы риска и вмешаться, чтобы изменить естественную траекторию когнитивного снижения и сохранить здоровье мозга в пожилом возрасте.
Другие факторы, ускоряющие старение органов
Недавние исследования выявили ряд дополнительных факторов, способных ускорять старение головного мозга. Так, в крупном когортном исследовании была продемонстрирована связь между хронической болью в колене при остеоартрите и структурными изменениями в головном мозге, включая гиппокамп, таламус и другие ключевые области, отвечающие за память. Оценка с использованием МРТ и когнитивных тестов показала, что наличие персистирующей боли повышает риск развития деменции в долгосрочной перспективе. Эти результаты подчёркивают, что даже на первый взгляд локализованные хронические состояния могут оказывать системное влияние на нейродегенеративные процессы.
После мозга именно скелетные мышцы стали, пожалуй, вторым наиболее активно исследуемым органом в контексте старения. Одним из преимуществ в изучении мышц является возможность получения образцов здоровой ткани на протяжении всей жизни человека. В прорывном исследовании биопсий мышц, взятых у 17 участников в возрасте от 20 до 75 лет, было секвенировано более 90 тысяч отдельных клеток и ядер. Анализ выявил целый ряд возрастных изменений: дисфункция стволовых клеток, повышенная экспрессия провоспалительных белков, активация иммунных каскадов и утрата нейронной иннервации, что в совокупности свидетельствует о постепенном снижении регенеративной способности мышечной ткани с возрастом.
Не менее показательно старение сердечной мышцы. Данные, полученные в исследованиях на макаках-резусах, показали, что с возрастом кардиомиоциты увеличиваются почти вдвое, по сравнению с молодыми особями. Это сопровождается ростом провоспалительной активности, фиброзом тканей (рубцеванием) и накоплением стареющих клеток. Особенно примечательно, что в клетках сердца фиксируются более выраженные соматические мутации, указывающие на дефицит репарации ДНК — более выраженный, чем в клетках головного мозга или лимфоцитах.
Эти данные подтверждают важный принцип: биологическое старение каждого органа — мозга, мышц, сердца и других систем — может происходить с разной скоростью у одного и того же человека. Наряду с этим, растущее количество генетических и омических данных подтверждает тесную взаимосвязь между органами, иллюстрируя, что «ни одна система не стареет в изоляции». В организме всё взаимосвязано, и нарушения в одном органе могут резонировать на уровне всей системы, ускоряя или изменяя траекторию старения других тканей.
Модуляция процесса старения
Можно ли замедлить старение? Современные исследования показывают, что да — и существует два ключевых направления воздействия: образ жизни+ и фармакологические вмешательства. Начнём с наиболее доступного — поведенческих стратегий.
Многочисленные исследования подтверждают, что даже на фоне генетической предрасположенности, наш образ жизни способен существенно модифицировать темпы старения и риск преждевременной смерти.
В одном из крупнейших исследований, включавшем более 350 000 участников UKBiobank, проводившихся более десяти лет, применялась полигенная шкала риска продолжительности жизни, оценивающая генетический вклад в старение. Результаты показали, что около 20% вариации в продолжительности жизни обусловлено наследственностью, тогда как влияние здорового образа жизни — независимо от генетики — было сопоставимо по силе. Более того, у людей с высоким генетическим риском, но благоприятными привычками, наблюдалось удлинение продолжительности жизни в среднем на пять лет.
Метаболомическая подпись долголетия
В другом исследовании, охватывавшем более 11 000 человек из четырёх независимых когорт, участников наблюдали на протяжении почти трёх десятилетий. Здесь исследователи сосредоточились на метаболомических маркерах, отражающих образ жизни: преимущественно липидный обмен, ИМТ и качество диеты. Эта "здоровая подпись" оказалась связана с:
· 25% увеличением вероятности дожить до 85 лет и старше,
· снижением общей смертности,
· меньшим риском развития сердечно-сосудистых заболеваний и рака.
Важно отметить, что обе вышеописанные работы преимущественно включали участников европеоидной расы, что требует осторожности при попытках распространения результатов на другие этнические группы.
Японский и китайский контексты
Особый интерес представляют исследования, проведённые в Восточной Азии. В проспективном наблюдении за 20 000 японцев в течение 21 года было показано, что здоровые привычки увеличивают продолжительность жизни, даже у пациентов с хроническими заболеваниями (сахарный диабет, сердечно-сосудистые болезни, онкология, почечная патология). Примечательно, что эффект наблюдался и в группе 80+ лет, а сила воздействия возрастала по мере увеличения числа здоровых привычек.
Среди этих факторов:
· сбалансированная диета,
· регулярный и полноценный сон,
· физическая активность,
· умеренное или нулевое потребление алкоголя,
· оптимальный ИМТ,
· отказ от курения.
Иллюстративный “дозовый эффект” (чем больше факторов — тем выше польза) чётко прослеживался в результатах (см. рис. 6).
Аналогично, в исследовании почти 1 500 китайских столетних людей, сравнение с контрольной группой людей того же возраста, не достигших 100 лет, показало, что самый высокий балл по шкале “здорового образа жизни” был чётко связан с достижением возраста 95 лет и выше.
Калорийность и долголетие: что мы знаем?
Хотя эффект ограничения калорий на продление жизни у грызунов давно и последовательно подтверждён, его влияние на приматов и людей остаётся менее однозначным.
Наиболее ярко эта неопределённость проявляется в двух масштабных и длительных исследованиях на нечеловеческих приматах, каждое из которых длилось более 20 лет:
· Одно проводилось в Университете Висконсина,
· Другое — в Национальном институте старения США (NIA).
Исследование Висконсина применяло более строгий протокол ограничения: обезьяны получали пищу один раз в день, что создавало 16-часовое окно голодания, приближая условия к режиму интервального голодания. В противоположность этому, в протоколе NIA пища оставлялась доступной на ночь, позволяя животным питаться свободно, что снижало степень реального ограничения калорий.
Результаты различались:
· Увеличение продолжительности жизни наблюдалось только в исследовании Висконсина.
· Однако оба исследования продемонстрировали улучшение продолжительности здоровья, выражающееся в снижении риска возрастных заболеваний, таких как диабет 2 типа, сердечно-сосудистые патологии и остеоартрит.
Этот контраст подчёркивает, что не только количество калорий, но и режим питания (включая длительность голодных промежутков) может играть ключевую роль. Он также служит напоминанием: данные, полученные на животных, не всегда напрямую транслируются на человека, особенно если условия питания существенно отличаются.
Ограничение калорий и его воздействие на иммунитет и старение
В разделе, посвящённом сенсорному восприятию питательных веществ, уже упоминались два исследования, показавшие, что умеренное сокращение калорийности рациона (на 12–14%) связано со снижением темпов биологического старения. Последующий отчёт по одному из этих проектов добавил новое измерение: влияние на иммунную систему.
Особенно поразительным оказалось восстановление вилочковой железы (тимуса) — органа, который с подросткового возраста постепенно утрачивает способность вырабатывать Т-клетки и замещается жировой тканью. В ответ на ограничение калорий:
· Жировая ткань подверглась ремоделированию.
· Зафиксировано значительное снижение экспрессии гена PLA2G7 — активатора тромбоцитов.
· Это снижение коррелировало с общим уменьшением системного воспаления.
Удаление гена PLA2G7 у пожилых лабораторных мышей продемонстрировало снижение воспаления и сохранение функции тимуса, тем самым подтверждая, что это вмешательство может положительно влиять на иммунное старение.
Периодическое голодание и имитирующие диеты: новый взгляд
Хотя различные формы интервального питания и периодического голодания не продемонстрировали устойчивого антивозрастного эффекта, они были связаны с:
· Улучшением иммунной функции,
· Благоприятными изменениями микробиома кишечника,
· Усилением противоопухолевой активности в доклинических моделях.
Отдельного внимания заслуживает подход "диеты, имитирующей голодание" (Fasting-Mimicking Diet, FMD) — низкокалорийный, низкобелковый и растительный рацион, применяемый в течение пяти дней каждые четыре недели.
В рандомизированном клиническом исследовании с участием 100 человек (средний возраст — 43 года, средний ИМТ — 27) три пятидневных цикла FMD привели к впечатляющим результатам:
· Повышение чувствительности к инсулину,
· Снижение жировой инфильтрации печени,
· Улучшение иммунного профиля (по соотношению лимфоцитов к лейкоцитам),
· Снижение биологического возраста на 2,5 года (по совокупности биомаркеров, а не по метилированию ДНК).
Диета долголетия: принципы и подход
Вальтер Лонго и Розалин Андерсон, ведущие исследователи из Университета Южной Калифорнии, являются сторонниками как FMD, так и более широкой концепции диеты долголетия. В одном из своих обзоров они описали её как:
«Рацион, преимущественно растительный, с умеренным или высоким содержанием углеводов и низким, но достаточным количеством белка, включающий регулярное потребление белка из песковегетарианских источников (например, рыба, морепродукты)».
Такой подход нацелен не только на увеличение общей продолжительности жизни, но и на пролонгирование периода активного, здорового старения.
Диеты с высоким содержанием жиров и потенциальные риски
С другой стороны, долгосрочное соблюдение высокожировой или кетогенной диеты всё чаще связывается с ускорением процессов старения — как в исследованиях на животных, так и у людей. В частности, наблюдается увеличение маркеров клеточного старения, что вызывает обоснованную настороженность.
Одним из ключевых факторов оказался дисбаланс микробиома кишечника. У мышей, получавших жирную диету, существенно возросло количество бактерий рода Desulfovibrio, сопровождавшееся увеличением продукции лейцина. Высокие уровни лейцина в крови также зафиксированы у женщин с раком молочной железы и плохим прогнозом, что наводит на мысль о более широкой патофизиологической роли этого аминокислотного метаболита.
Экспериментальные модели показали, что:
· Лейцин активирует сигнальные пути в костном мозге, стимулируя клетки-супрессоры миелоидного происхождения (MDSC),
· Активируется путь mTOR, известный своей ролью в клеточном росте и старении,
· Усиливается пролиферация опухолевых клеток.
В совокупности с сердечно-сосудистыми рисками эти данные свидетельствуют: долговременное следование кетогенным диетам может нести потенциальную угрозу здоровью, особенно в контексте старения и хронических заболеваний.
Таурин — перспективный кандидат в антивозрастной терапии
На сегодняшний день ни одна пищевая добавка не продемонстрировала достоверного увеличения продолжительности жизни у человека. Однако одним из наиболее перспективных соединений стал таурин — аминокислота, уровень которой естественным образом снижается с возрастом.
Исследования показывают:
· Низкий уровень таурина ассоциирован с усиленным воспалением и повышенным риском возрастных заболеваний.
· У лабораторных обезьян добавки с таурином приводили к увеличению продолжительности жизни,
· Также наблюдалось снижение клеточного старения, воспаления и признаков митохондриальной дисфункции.
Хотя результаты внушают оптимизм, рандомизированные клинические испытания на людях ещё не завершены. Их итоги будут критически важны для оценки потенциальной роли таурина в замедлении процессов старения и улучшении метаболического здоровья.

Физическая активность как ключ к здоровому долголетию
Физические упражнения оказывают мощное, всестороннее воздействие на здоровье и продолжительность жизни. Они способствуют снижению хронического воспаления, укрепляют иммунную защиту, уменьшают проявления атеросклероза, улучшают чувствительность к инсулину и снижают риск метаболического синдрома и диабета 2 типа. Кроме того, систематическая физическая активность коррелирует со снижением заболеваемости рядом онкологических заболеваний — этот эффект был подтверждён во множестве научных работ.
В масштабном исследовании, охватившем более 650 000 человек в возрасте от 21 до 90 лет и продолжавшемся 10 лет, было зафиксировано значительное увеличение продолжительности жизни у людей, регулярно занимающихся физической активностью. Показатели измерялись в метаболических эквивалентах (MET-часов в неделю). Выяснилось, что 450 минут обычной ходьбы в неделю обеспечивают в среднем до 4,5 дополнительных лет жизни по сравнению с сидячим образом жизни.
Упражнения как способ "перезагрузки" биологического возраста
Стивом Хорватом, одним из авторов эпигенетических часов, было установлено, что физические упражнения — на сегодняшний день единственное подтверждённое средство, способное замедлять или даже “отматывать” биологический возраст у человека.
Многие положительные эффекты объясняются действием экзеркинов — биологически активных молекул, высвобождаемых в ответ на физическую нагрузку. Например:
· Интерлейкин-10 оказывает выраженное противовоспалительное действие,
· Интерлейкин-6, несмотря на его репутацию как провоспалительного цитокина, в контексте тренировки может выполнять адаптационную роль, моделируя стрессовую реакцию и укрепляя устойчивость организма.
В одном из исследований у пациентов с раком поджелудочной железы один час аэробной и силовой нагрузки вызывал мощную иммунную реакцию: наблюдался всплеск CD8+ цитотоксических Т-клеток, сопровождающийся удвоением их времени жизни, что потенциально усиливает противоопухолевый иммунитет.
Молекулярные преобразования под воздействием тренировок
В 2016 году Национальные институты здравоохранения (NIH) запустили широкомасштабную программу изучения молекулярных преобразователей физической активности, охватившую как животных, так и более 2 500 участников.
Ключевые открытия, полученные при изучении крыс, проходивших восьминедельную программу на беговой дорожке, включали:
· Улучшение митохондриальной функции,
· Снижение системного воспаления,
· Предотвращение прогрессирования аутоиммунных состояний, таких как воспалительные заболевания кишечника,
· Защита от неалкогольной жировой болезни печени.
Более того, в отдельных экспериментах было показано, что у пожилых мышей регулярные физические нагрузки способствуют омоложению стволовых клеток скелетных мышц, улучшая их способность к регенерации.
Прочие факторы образа жизни и окружающей среды, влияющие на старение
Существует множество аспектов образа жизни, которые исследовались с точки зрения их потенциального влияния на процессы старения — как ускоряющего, так и замедляющего характера.
Воздействие табака, особенно на ранних этапах — в период внутриутробного развития или в детстве, — было связано с ускоренным эпигенетическим старением. Тяжёлые хирургические вмешательства, сопровождающиеся физиологическим стрессом, также увеличивают скорость биологического старения. Более того, социальный стресс — например, вызванный одиночеством или отсутствием поддержки — способствует старению иммунной системы, подрывая её защитные функции.
Влияние увлечений, оптимизма и социальных связей
Результаты крупного многонационального исследования с участием более 92 000 пожилых людей (65 лет и старше) из 16 стран показали, что наличие хобби и увлечений (творчество, настольные игры, головоломки, рукоделие и т. д.) связано с улучшением общего состояния здоровья и замедлением старения.
Наряду с увлечениями, оптимизм также оказался значимым фактором: по данным метаанализа, он ассоциирован с увеличением продолжительности жизни на 11–15%. К этому стоит добавить ещё один важный компонент: социальная вовлечённость. Недавнее исследование с применением искусственного интеллекта и анализа электрокардиограммных биометрических показателей старения среди 280 000 человек показало, что наименьшие показатели биологического старения наблюдались у тех, кто не испытывал социальной изоляции.
Сон, циркадные ритмы и среда обитания
Известно, что с возрастом нарушаются качество сна и циркадные ритмы, что напрямую связано с ухудшением здоровья. Между тем, по данным анализа на основе эпигенетических часов PhenoAge, улучшение сна может замедлить биологическое старение.
Ещё один неожиданно важный фактор — окружающая среда. Исследования выявили, что загрязнение воздуха, особенно от транспортных средств, и неблагополучные районы проживания (с заброшенными автомобилями, плохими дорогами, агрессивной визуальной средой и отсутствием зелёных зон) связаны с ускоренным старением на клеточном уровне. Пространство, в котором мы живём, может оказывать не менее сильное воздействие на наш биологический возраст, чем диета или физическая активность.
Вмешательства для замедления и возможного обращения старения
Модулировать процесс старения — уже значительное достижение. Но по-настоящему заманчивой целью остаётся обращение функциональных нарушений, связанных с возрастом. Возможно ли это? Пока что убедительных доказательств немного, но они интригуют и воодушевляют. Начнём с одного из ключевых направлений — омоложения иммунной системы.
Омоложение иммунной системы
На сегодняшний день установлено, что возрастные изменения в иммунной системе, известные как иммуностарение, тесно связаны с дефектами в механизмах репарации ДНК. Эти нарушения лежат в основе старения целого ряда органов, включая печень, почки, поджелудочную железу и лёгкие. Современные методы, такие как одноклеточное секвенирование миллионов иммунных клеток у людей разных возрастов, позволяют точно определить, какие популяции клеток наибольшим образом поражены старением.
Были протестированы три принципиально разных подхода к потенциальному обращению иммунного старения. Один из наиболее известных экспериментов включал комбинацию рекомбинантного человеческого гормона роста, метформина и дегидроэпиандростерона (DHEA), которую получала небольшая группа из десяти мужчин в возрасте от 50 до 65 лет. Из трёх компонентов только гормон роста ранее демонстрировал влияние на вилочковую железу — орган, критически важный для выработки Т-клеток.
Результаты оказались многообещающими: МРТ выявила признаки регенерации ткани вилочковой железы, уровни воспалительных маркеров снизились, а показатели иммунной функции — улучшились. Эпигенетический возраст, рассчитанный по часам Хорвата и GrimAge, в среднем уменьшился на 1,5 года. При последующем наблюдении за участниками эффект усилился — снижение составило дополнительно один год.
Однако, несмотря на эти перспективные данные, гормон роста как средство продления жизни остаётся спорным. Хотя известно, что с возрастом его уровень снижается, а добавки могут улучшать мышечную массу и плотность костной ткани у пожилых, он также связан с повышенным риском развития инсулинорезистентности. Более того, на сегодняшний день отсутствуют убедительные данные, подтверждающие его влияние на увеличение продолжительности жизни у людей.
У пожилых мышей четырёхдневное применение препарата, способствующего восстановлению полярности кроветворных стволовых клеток — процесса, нарушающегося с возрастом — привело к обращению эпигенетических часов и увеличению продолжительности жизни. Аналогичный антивозрастной эффект наблюдался и у старых иммунодефицитных мышей после трансплантации омоложённых кроветворных стволовых клеток. Эти вмешательства изменили баланс в иммунной системе в сторону повышенного производства лимфоцитов вместо клеток врождённого иммунитета (лейкоцитов), что стало основой для следующего важного исследования, опубликованного в Nature.
В этом подходе использовались антивозрастные антитела, специально нацеленные на патологически активные стареющие стволовые клетки — так называемые миелоидные гемопоэтические клетки, которые считаются ключевыми источниками хронического воспаления (иммуновоспаления). Их избирательное удаление позволило переключить иммунную систему: от доминирования врождённого иммунитета — к омоложённому адаптивному, с увеличением продукции Т- и В-лимфоцитов. Примечательно, что однократная инъекция обеспечивала стабильный омолаживающий эффект в течение нескольких месяцев, усиливая способность организма к противовирусной защите у старых мышей по сравнению с контрольной группой.
Тем не менее, остаётся важная проблема: вмешательство в иммунный баланс может иметь непредсказуемые последствия. Смещение в сторону адаптивного иммунитета и стимуляция его пролиферации теоретически повышают риск развития лимфоидных злокачественных опухолей, таких как Т- и В-клеточные лимфомы. Как и в случае с другими антивозрастными стратегиями, здесь требуется предельная осторожность, клиническая валидация и оценка рисков перед потенциальным применением у людей.
Эпигенетическое перепрограммирование: вызовы и возможности
Хуан Карлос Бельмонте — пионер в области эпигенетического перепрограммирования — в своей знаковой работе продемонстрировал возможность омоложения мышей с мутацией, вызывающей прогерию — модель ускоренного старения. Он разработал дилеммы, с которыми сталкивается компания Altos Labs, в которую уже вложено более 3 миллиардов долларов, но которая до сих пор не приступила к первому клиническому испытанию на людях.
Одним из главных препятствий является онкогенный риск: системное введение факторов Яманаки (OCT4, SOX2, KLF4 и c-MYC) даже в краткосрочном режиме способно спровоцировать развитие злокачественных новообразований. Особенно опасны c-MYC и OCT4, которые могут трансформировать нормальные клетки в опухолевые. В ряде экспериментов после воздействия факторов у животных формировались тератомы.
Тем не менее, команда Бельмонте доказала, что короткие импульсы экспрессии всех четырёх транскрипционных факторов, как при системном введении, так и при локализованном воздействии на ткани, не вызывали онкогенных эффектов в течение целого года наблюдения в мышиных моделях. Это открывает перспективу тканеспецифического применения. Например, введение факторов Яманаки локально в сустав, поражённый тяжёлым остеоартритом, может стать обоснованным первым шагом к терапевтическому применению.
Ещё более впечатляющие результаты были получены в глазах старых мышей с глаукомой: локальное введение трёх факторов Яманаки привело к восстановлению зрения и обратному ходу эпигенетических часов клеток сетчатки. Однако во всех подобных подходах ключевым остаётся поиск баланса между омолаживающим эффектом и риском онкологических трансформаций.
Применение коротких, контролируемых импульсов, в сочетании с тканевой или даже клеточной избирательностью (нацеливание на повреждённые клетки, а не системное воздействие), представляется наиболее перспективной стратегией для минимизации рисков при сохранении терапевтической пользы.
Одной из потенциальных стратегий может стать омоложение иммунной системы у пациентов с терминальной стадией рака. Однако этот подход сопряжён с серьёзным риском — в частности, с возможным развитием синдрома высвобождения цитокинов, крайне опасного состояния, вызванного неконтролируемой активацией иммунного ответа, которое в отдельных случаях может быть фатальным.
Альтернативной и более безопасной возможностью могло бы стать точечное воздействие на ткань тимуса — ключевой орган, ответственный за созревание Т-клеток. Пример тому — ранее проведённые эксперименты с использованием гормона роста, способствовавшего регенерации тимуса. Однако в настоящее время методы высокоточной доставки терапевтических агентов в этот орган остаются на стадии разработки.
В качестве замены гормону роста рассматривается стратегия частичного эпигенетического перепрограммирования. Для этого используется комбинация факторов Яманаки (OKSM) с добавлением LIN28 и NANOG — двух дополнительных регуляторных белков, известных своей ролью в поддержании плюрипотентности. Эта методика уже была опробована в культуре клеток, включая иммунные клетки, где она показала способность обращать вспять эпигенетические и воспалительные изменения. Однако до сих пор она не прошла проверку в живых организмах, ни в экспериментальных животных моделях, ни, тем более, в клинических испытаниях на людях.
Тем не менее, подход с использованием перепрограммированных иммунных клеток вне организма (экс виво), например, для омоложения Т-клеток, применяемых в онкоиммунотерапии, уже рассматривается как перспективное направление. Такие клетки могли бы получить эпигенетическое «перезарядку» перед введением пациенту.
Стоит отметить, что десятки биотехнологических компаний делают ставку на стратегию частичного эпигенетического перепрограммирования, инвестируя в разработку платформ и терапий на его основе. Среди них — Altos Labs, New Limit, Rejuvenate Bio, Life Biosciences, YouthBio Therapeutics, Shift Bioscience, Retro Biosciences и многие другие. Это направление, несомненно, входит в число наиболее горячих точек роста в биомедицинской науке, обещая не только омоложение клеток, но и фундаментальное переосмысление самого понятия возрастной терапии.
«Молодая кровь»: от парабиоза к факторам омоложения
Поиски источника молодости неизбежно приводят нас к феномену «молодой крови». Уже более двадцати лет известно о её потенциально омолаживающем действии. Первые эксперименты основывались на методике гетерохронного парабиоза — хирургического соединения кровеносных систем старой и молодой мышей. Эти исследования продемонстрировали улучшение функции нескольких органов у пожилого животного и ухудшение параметров здоровья у молодого, что указывало на значительное влияние системных факторов крови.
При поддержании парабиоза на протяжении трёх месяцев у старых мышей наблюдалось продление жизни, обратное развитие эпигенетических часов, улучшение физических показателей и омолаживающие изменения в тканевых омических сигнатурах. Более того, положительный эффект сохранялся даже спустя месяцы после разъединения животных. Хотя эти впечатляющие результаты пока не были полностью воспроизведены, другие независимые исследования поставили под сомнение устойчивость наблюдаемых эффектов. Предполагая, что благоприятное действие всё же подтверждается, остаётся вопрос практической реализации: очевидно, соединение кровотоков у людей — невозможный путь, и гораздо более важно понять, что именно в молодой крови даёт омолаживающий эффект.
Одним из возможных решений стало введение молодой плазмы старым мышам. После восьми инфузий в течение 24 дней отмечались улучшение памяти и когнитивных функций, усиление нейрогенеза и синаптической пластичности гиппокампа, что сопоставимо с эффектами парабиоза. Интересно, что однократная замена половины объёма плазмы у пожилых мышей на раствор альбумина и физиологический раствор (в течение 30 минут) приводила к похожим мультисистемным эффектам: от улучшения когнитивной функции до снижения воспаления, восстановления печени и скелетных мышц. Это натолкнуло на гипотезу, что омолаживающий эффект может быть связан не с добавлением молодых факторов, а с разбавлением или удалением возрастных провоспалительных белков.
Дополнительные данные поступили из исследований крови тренированных животных: введение плазмы от физически активных старых мышей их малоподвижным сородичам улучшало функции мозга и синаптическую пластичность. В этом случае роль ключевого медиатора играл печёночный фактор Gplp1.
Тем не менее, точные омолаживающие компоненты крови молодых животных пока не выявлены. Среди потенциальных кандидатов: GDF11, Klotho, остеокальцин, тромбоцитарный фактор 4 (PF4), малые внеклеточные везикулы, а также другие молекулы. В одном эксперименте одноразовое введение низкой дозы Klotho приматам приводило к значимому улучшению когнитивных функций. Что касается PF4, его прямое введение воспроизводило нейропротективный эффект молодой плазмы, снижая воспаление и восстанавливая память у старых мышей.
На основе этих находок начаты клинические испытания, где изучаются эффекты плазменных факторов на пациентов с болезнью Паркинсона, сопровождающейся когнитивными нарушениями, а также на людей с болезнью Альцгеймера лёгкой и умеренной степени. Несмотря на все сложности, направление «омолаживающих факторов крови» остаётся одним из наиболее амбициозных и многообещающих в биомедицине.
Поиски «эликсира молодости» привели учёных и к исследованию цереброспинальной жидкости. Переливание молодой спинномозговой жидкости старым мышам, как и инфузии молодой плазмы, демонстрировало омолаживающий эффект. Было установлено, что одного лишь фактора роста фибробластов 17 (Fgf17) достаточно для достижения значительных улучшений в когнитивной функции. Несмотря на то, что большинство подобных экспериментов было выполнено на грызунах, недавнее исследование с введением плазмы от молодых свиней старым крысам также показало обратимое влияние на эпигенетические часы, что свидетельствует об универсальности эффекта.
Человеческие исследования пока ограничены и носят предварительный характер. В одном небольшом рандомизированном исследовании девять пациентов с болезнью Альцгеймера получали плазму от молодых доноров. Оно подтвердило безопасность процедуры, но не выявило явных клинических улучшений. В условиях неопределённости в отношении конкретных омолаживающих факторов и потенциальных рисков, наиболее безопасной стратегией считается разбавление возрастных факторов крови путём плазмафереза — процедуры, при которой из организма удаляется и замещается значительная часть плазмы (до 60–70%). В исследовании с участием трёх добровольцев, прошедших по три курса TPE(терапевтический обмен плазмы) в течение года, было зафиксировано снижение воспаления и уровня биомаркеров, ассоциированных с нейродегенерацией и онкологическими процессами.
Тем не менее, несмотря на отсутствие убедительных доказательств пользы и безопасности, коммерциализация этих подходов началась. Так, компания Ambrosiaпредлагала инфузии плазмы от доноров в возрасте 16–25 лет по цене 8 000 долларов за литр. В 2019 году FDA выпустило официальное предупреждение, заявив, что «некоторые пациенты становятся жертвами недобросовестных деятелей». Однако это не остановило рынок: Next Health продолжает предлагать плазмаферез за 10 000 долларов, аналогичные услуги предоставляют Young Blood Institute, Maxwell Clinic и другие учреждения. Помимо высокой стоимости и отсутствия подтверждённой эффективности, важно понимать и реальные риски, включая возможные иммунные реакции, инфекции и электролитные нарушения, связанные с инфузиями плазмы и TPE.
Омолаживающий эффект молодой крови выходит за рамки только плазмы или спинномозговой жидкости. Воздействие распространяется и на кишечную микробиоту: трансплантация фекальной микробиоты от молодых мышей старым улучшала функции кишечника, глаз и головного мозга. Напротив, пересадка микробиоты от старых животных молодым вызывала противоположные — воспалительные и дегенеративные — эффекты, ещё раз подчёркивая системное значение микробиома в процессе старения.
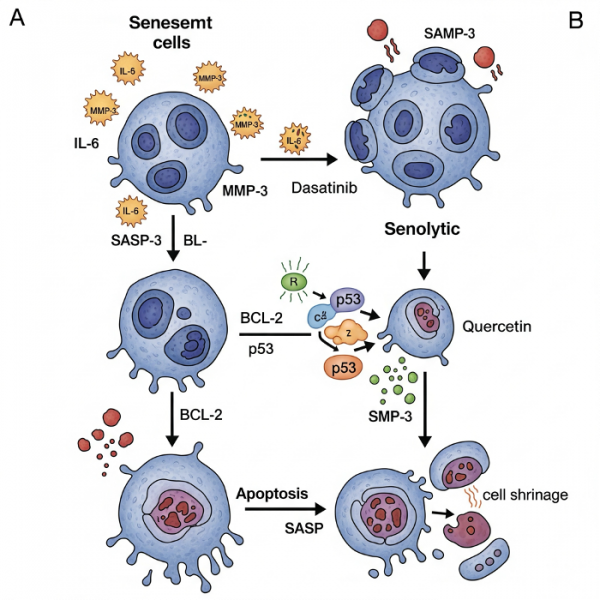
От зомби-клеток — к терапии: как избавление от стареющих клеток открывает путь к омоложению
Речь идёт о так называемых сенесцентных, или стареющих клетках, чьё присутствие в тканях связано с хроническим воспалением, деградацией функций органов и ускорением старения. Эти клетки не делятся, но продолжают существовать в организме, выделяя разрушительные провоспалительные сигналы — сенесцентный секреторный фенотип (SASP), что делает их биологическими "зомби".
Сенолитики первого и второго поколения
Ещё в 2015 году ученые из Scripps Research совместно с исследователямм из MayoClinic опубликовали революционное исследование, показавшее, что комбинация сенолитиков — препаратов, избирательно уничтожающих стареющие клетки — значительно улучшает здоровье мышей. С тех пор накоплен огромный массив данных, подтверждающих эффективность такого подхода в доклинических моделях.
Первое поколение сенолитиков
К первому поколению сенолитических агентов относятся:
· Дазатиниб — ингибитор тирозинкиназы, уже используемый в лечении лейкемии;
· Кверцетин и физетин — природные флавоноиды, обладающие проапоптотическим эффектом, способствующим самоуничтожению стареющих клеток;
· Навитоклакс — препарат, подавляющий семейство белков BCL-2, препятствующих естественной гибели стареющих клеток.
Эти препараты помогают преодолеть устойчивость сенесцентных клеток к апоптозу — запрограммированной клеточной гибели, — которая обычно препятствует их устранению организмом.
Второе поколение: прецизионные технологии
К более современным, «второго поколения» подходам относятся:
· CAR-T-клетки, перенаправленные на устранение сенесцентных клеток;
· Наночастицы, способствующие разрушению сенесцентных клеток через воздействие на специфические маркеры, такие как β-галактозидаза;
· Мишени, влияющие на глутаминазу-1 (GLS1), участвующую в метаболизме сенесцентных клеток.
В отличие от концепции «молодой крови», где клинические исследования ещё не показали стабильной пользы, сенолитическая терапия уже вошла в клиническую фазу. Сегодня во всём мире активно проводятся испытания первой и второй фаз с участием различных сенолитиков.
Текущие клинические испытания
Клинические исследования уже запущены для изучения воздействия сенолитиков при таких состояниях, как:
· Идиопатический лёгочный фиброз
· Диабетическая нефропатия
· Болезнь Альцгеймера
· Остеоартрит
· Возрастная слабость
· Сепсис
· Макулярный отёк при диабете
Небольшие пилотные исследования показали, что комбинация дазатиниба и кверцетина действительно способствует очищению тканей от стареющих клеток у пациентов с диабетической нефропатией и лёгочным фиброзом. Однако клинически значимые эффекты, например при остеоартрите коленного сустава или в улучшении минеральной плотности костей у женщин в постменопаузе, пока не были достигнуты.
Сенолитическая терапия: клинические шаги и новые горизонты
Одним из самых многообещающих направлений применения сенолитиков стало лечение диабетического макулярного отека, особенно у пациентов, не ответивших на стандартную терапию. В клиническом испытании с участием девятнадцати таких пациентов локальное введение фоселутоклакса — селективного ингибитора BCL-семейства от компании Unity Biotechnology — продемонстрировало значимые улучшения: повышение остроты зрения, восстановление сосудистого русла и благоприятная перестройка сетчатой оболочки глаза. Эти данные подтверждают потенциал сенолитиков при офтальмологических осложнениях возрастного и метаболического происхождения.
Сенолитики при нейродегенерации и вирусной инфекции
В другом небольшом исследовании у пяти пациентов с начальной стадией болезни Альцгеймера пероральный приём дазатиниба и кверцетина в течение двенадцати недель привёл к улучшениям в одиннадцати биомаркерах плазмы крови и шести показателях спинномозговой жидкости, ассоциированных с клеточным старением. Однако был также отмечен высвобожденный интерлейкин-6, свидетельствующий о потенциальной воспалительной реакции, вызванной лизисом стареющих клеток — эффект, за которым потребуется дальнейшее наблюдение и уточнение.
Интересные данные были получены и в связи с пандемией COVID-19: в посмертных образцах мозга пациентов, умерших от тяжёлого течения коронавирусной инфекции, было выявлено значительное накопление стареющих клеток по сравнению с контрольными группами аналогичного возраста. Это предполагает, что вирус может индуцировать клеточное старение, особенно в иммунных и нейрональных тканях.
В экспериментах in vitro, на тканевых органоидах, сенолитики успешно элиминировали стареющие клетки, а в двух животных моделях COVID-19 их применение привело к существенному снижению воспаления и улучшению общего состояния. Эти находки открывают потенциал для применения сенолитиков в лечении постковидного синдрома и других вирус-индуцированных патологий, сопровождающихся клеточным старением.
Новые молекулы и искусственный интеллект
Значительно ускорился и поиск новых сенолитических агентов. Методы глубокого машинного обучения позволили идентифицировать перспективные малые молекулы с высокой селективностью к стареющим клеткам. Используя базы данных биомолекулярных взаимодействий и предиктивные модели, исследователи уже выделили несколько десятков кандидатов, находящихся на этапе доклинической оценки.
SGLT-2 ингибиторы и сенолитики нового поколения: потенциал в антивозрастной терапии
Ингибиторы натрий-глюкозного котранспортера 2-го типа (SGLT-2), такие как эмпаглифлозин (Jardiance) и канаглифлозин (Invokana), давно зарекомендовали себя в лечении сахарного диабета 2 типа, демонстрируя снижение общей смертности и улучшение сердечной функции у пациентов с сердечной недостаточностью с сохраненной фракцией выброса. Однако механизмы, лежащие в основе этих клинических преимуществ, всё ещё остаются недостаточно изученными.
Интригующие данные из экспериментов на мышах показали, что ингибиторы SGLT-2 обладают сенолитической активностью — способностью устранять стареющие клетки, — и, что особенно важно, улучшают выживаемость даже при назначении в среднем возрасте. Если эти эффекты подтвердятся у людей, препараты этого класса могут получить новое применение в геропротективной медицине — как средства продления активной жизни.
Сенолитики второго поколения: генная инженерия на службе долголетия
Ключевым прорывом стали сенолитики второго поколения, использующие генетически модифицированные CAR-T-клетки, нацеленные на урокиназный рецептор плазминогена (uPAR) — маркер стареющих клеток. В экспериментах на старых мышах однократная инъекция CAR-T-клеток не только эффективно устраняла стареющие клетки, но и обеспечивала устойчивое улучшение физической выносливости и метаболических параметров, включая снижение уровня глюкозы в крови. Эти результаты открывают перспективу для персонализированных антивозрастных иммунотерапий.
Эта технология также была успешно применена для омоложения кишечника у старых мышей, что дополнительно подтверждает органоспецифическую эффективность такого подхода. В параллельных разработках ученые исследуют расширение популяции естественных киллерных Т-клеток (NK-клеток) — ещё один способ нацеленной элиминации стареющих клеток. Такие методы уже показали эффективность при лечении возрастного фиброза лёгких у мышей и в настоящее время проходят подготовку к клиническому этапу.
Трудности селективного устранения стареющих клеток и перспективы таргетной терапии
Одной из главных нерешённых задач в области антивозрастных вмешательств остаётся разработка точного и селективного подхода к элиминации стареющих клеток. Вместе с тем, не все стареющие клетки вредны: некоторые из них выполняют важные регуляторные и восстановительные функции, особенно в контексте заживления тканей и противоопухолевой защиты. Именно поэтому бездумное их удаление может обернуться непредсказуемыми последствиями для организма. Простое применение сенолитиков, успешное в экспериментах на мышах, не обязательно переносимо на человека в силу большей сложности и гетерогенности тканей.
Здесь в игру вступает Сеть клеточного старения (SenNet) — научная инициатива, направленная на идентификацию уникальных биомаркеров клеточного старения, что, в перспективе, позволит создавать таргетные препараты нового поколения. Такие маркеры позволят отличать «вредные» стареющие клетки от функционально полезных, увеличивая избирательность сенолитиков и снижая риски.
Хотя клиническое применение сенолитиков у людей пока находится на начальных стадиях, первые исследования демонстрируют обнадёживающие результаты, особенно в контексте некоторых возрастных заболеваний и патологий, ассоциированных с хроническим воспалением.
Альтернативным направлением исследований является стимуляция естественных механизмов клеточной очистки, в первую очередь — аутофагии. Этот процесс позволяет клетке утилизировать повреждённые компоненты и молекулярный «мусор», поддерживая её функциональность. Молекулы, такие как спермидин, уролитин А, а также агенты, улучшающие митохондриальную активность и работу сублизосомальных органелл, показывают потенциал в стимулировании аутофагии и уменьшении признаков клеточного старения. Однако, несмотря на положительные результаты на модельных организмах, клинические данные у людей пока отсутствуют, и необходимость в контролируемых испытаниях остаётся актуальной.
Менопауза как биомаркер воспалительного старения и новые горизонты терапии
Существует ли более выраженный маркер биологического старения, сопровождающийся воспалением, чем менопауза? По данным органоспецифических часов старения, заместительная гормональная терапия эстрогенами демонстрирует способность замедлять биологическое старение ряда ключевых систем — особенно иммунной, церебральной, печёночной и сердечно-сосудистой. Эти данные подтверждают хорошо известный клинический факт: менопауза ассоциирована с ростом частоты возрастозависимых патологий, включая ишемическую болезнь сердца, остеопороз и нарушения иммунного гомеостаза.
Однако гормональная терапия сопряжена с потенциальными рисками, что побуждает исследователей искать альтернативные пути. Одним из таких направлений стало продление функционального ресурса яичников. Впечатляющие данные были получены при трансплантации яичников: старые мыши, получившие трансплантат от молодых особей, демонстрировали увеличение продолжительности жизни. Этот эффект не остался незамеченным: компания Oviva Therapeutics разрабатывает гормональный препарат, способный поддерживать овариальную активность у животных, включая мышей и кошек.
Параллельно проводится пилотное рандомизированное клиническое исследование с участием женщин в возрасте от 35 до 45 лет, демонстрирующих признаки перименопаузального перехода. Испытуемым назначают еженедельный приём 5 мг рапамицина или плацебо в течение трёх месяцев. Главный параметр оценки эффективности — овариальный резерв, выступающий как суррогатный маркер потенциального продления функции яичников.
Хотя эти исследования находятся на начальной стадии, сама постановка вопроса меняет парадигму: как справедливо заметила Рене Вегрзин, директор Агентства перспективных биомедицинских исследований (ARPA-H), «яичники — это единственный орган человека, отказ которого мы воспринимаем как должное». Современная наука всё чаще оспаривает это пассивное принятие, прокладывая путь к новой эре репродуктивного и системного омоложения.
Собаки и долголетие: неожиданные союзники в антивозрастной науке

Когда речь заходит о продлении жизни, мы не можем не вспомнить наших старых и преданных спутников — собак. В одном из ранних рандомизированных исследований, проведённом на пожилых собаках (n=59), оценивалось воздействие сенолитического препарата в сочетании с добавкой NAD+. Животные были разделены на три группы: получавшие низкую дозу, полную дозу и плацебо. По наблюдениям владельцев, в группе, получавшей полную дозу, отмечалось умеренное улучшение когнитивной функции. Хотя выводы остаются предметом научной дискуссии, эти данные поднимают важный вопрос: могут ли наши питомцы стать моделью для испытаний антивозрастных вмешательств?
Особого внимания заслуживает компания Loyal, разрабатывающая прорывной препарат LOY-001, ориентированный на снижение уровня инсулиноподобного фактора роста IGF-1 — молекулы, потенциально связанной с механизмами старения. Известно, что собаки мелких пород с естественно низким уровнем IGF-1 живут значительно дольше. LOY-001 вводится ежеквартально собакам старше семи лет с массой тела более 18 кг и, как показали предварительные данные, эффективно снижает IGF-1.
Сейчас препарат проходит плацебо-контролируемое клиническое испытание с участием более тысячи собак, цель которого — проверить, способна ли терапия реально продлить продолжительность жизни. Кроме того, у компании в разработке ещё два пероральных препарата, свойства которых пока не разглашаются, но они также вскоре будут тестироваться в масштабных рандомизированных исследованиях.
Однако самое знаковое достижение — не сами препараты, а регуляторный прецедент: Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) предварительно одобрило использование LOY-001 именно с целью продления жизни, что может стать поворотным моментом в регулировании антивозрастных технологий. Неудивительно, что эта новость в конце 2023 года попала на первую полосу New York Times — не только из-за любви к собакам, но и как предвестие революции в медицине долголетия.
Рапамицин и долголетие: взгляд с собачьей перспективы
Одним из наиболее обсуждаемых препаратов в контексте антивозрастной терапии является рапамицин — и его масштабное тестирование ведётся не на людях, а на... собаках. Рандомизированное исследование препарата проводится в рамках амбициозного проекта Dog Aging Project, финансируемого Национальными институтами здравоохранения США (NIH). Этот проект отслеживает состояние почти 50 000 домашних собак, располагает биобанком более 14 000 образцов тканей и крови, а также секвенировал свыше 1 000 геномов. Однако дальнейшее финансирование программы, несмотря на её значимость, находится под угрозой.
То, что рапамицин тестируется именно на собаках в таком масштабе, важно — ведь аналогичных клинических исследований на людях попросту не существует. Как и ограничение калорий, рапамицин и его производные (так называемые рапалоги) подавляют активность сигнального пути mTOR, который регулирует ключевые клеточные процессы — от синтеза белка до аутофагии (клеточного «очищения»). Из 12 ключевых признаков старения, о которых часто говорят геронтологи, подавление mTOR затрагивает большинство.
В доклинических исследованиях рапамицин продлевал жизнь от 20% у нематод до 60% у мышей. У пожилых людей он показал умеренное ослабление иммунного старения, усиливая ответ на вакцинацию и интерфероновую активность при вирусных инфекциях. Однако этот же препарат может вызывать иммуносупрессию, повышая уязвимость к инфекциям — эффект, вызывающий серьёзные опасения при систематическом применении.
Анализ всей доступной литературы показывает: у людей нет убедительных доказательств, что рапамицин улучшает когнитивные функции, память, мышечную массу или метаболизм глюкозы. Однако топическое применение рапамицина на кожу показало снижение биомаркеров старения кожи, что может указывать на локальные положительные эффекты.
Несмотря на обширные данные об эффекте рапамицина в животных моделях, остаётся неизвестной оптимальная доза для человека, и значимых клинических испытаний по замедлению старения или лечению возрастных заболеваний не проводится. Принимая во внимание потенциально серьёзные побочные эффекты, в частности, подавление иммунной системы, на сегодняшний день нет достаточных оснований для его использования в качестве антивозрастной терапии у людей.
Антивозрастная фармакология
Метформин, NAD⁺ и сиртуины: надежды и разочарования антивозрастной фармакологии
В то время как рапамицин остаётся предметом обсуждений, другой кандидат на роль антивозрастного средства — метформин — демонстрирует широкий спектр потенциально благоприятных биологических эффектов. Его влияние на аутофагию и митохондриальную функцию делает его особенно интересным в контексте геронтологии. В настоящее время продолжается крупное клиническое исследование с участием трёх тысяч человек в возрасте от 65 до 79 лет, цель которого — оценить влияние метформина на старение и возрастные заболевания.
Однако даже при успешном завершении это исследование может оказаться недостаточно масштабным, чтобы предоставить статистически значимые и клинически убедительные доказательства эффективности препарата в контексте продления жизни или улучшения её качества. Кроме того, финансирование остаётся нерешённой проблемой.
Ранее опубликованный метаанализ 166 исследований показал, что метформин может быть связан с снижением риска развития различных видов рака, однако практически все существующие данные основаны на наблюдательных, нерандомизированных исследованиях — а это, как известно, оставляет пространство для систематических ошибок и искажающих факторов. Более того, у пожилых людей метформин может снижать способность к наращиванию мышечной массы при физических упражнениях, что делает его использование неоднозначным именно в той возрастной группе, где он мог бы быть наиболее полезным.
Отдельного внимания заслуживает молекула никотинамид-аденин-динуклеотид (NAD⁺) — ключевой компонент митохондриального энергетического метаболизма, уровень которого заметно снижается с возрастом и особенно резко — при развитии возрастных заболеваний. Наш организм не способен получать NAD⁺ напрямую из пищи. Вместо этого рынок заполнили предшественники NAD⁺, такие как никотинамид рибозид (NR) и никотинамид мононуклеотид (NMN), которые продаются как БАДы без клинических доказательств эффективности. Тем не менее, их совокупные мировые продажи прогнозируются на уровне более одного миллиарда долларов в ближайшие два года — яркое свидетельство того, как рыночные силы могут опережать научную валидацию.
Снижение NAD⁺ также связано с активностью так называемого сиртуинового пути. Эти белки — производные «молчаливых регуляторов информации» (Sir) — когда-то считались ключевыми факторами продления жизни, особенно после открытия ресвератрола в красном вине. Однако повторные исследования не смогли воспроизвести ожидаемый эффект, и сегодня сиртуины рассматриваются скорее как модуляторы процессов старения, чем как универсальные рычаги его обратимости. Обобщая всё, можно сказать: если судить по доказательной базе, роль сиртуинов в старении, скорее, молчалива, чем революционна.
Инновационные мишени: митохондрии, воспаление и ось «кишечник–мозг»
Одним из перспективных направлений в антивозрастной фармакологии остаются препараты, воздействующие на митохондриальные функции. Один из таких кандидатов — препарат ATX-304 от компании Cambrian Bio — завершил ранние фазы клинических испытаний. Его механизм основан на активации аденозинмонофосфат-активируемой протеинкиназы (AMPK), широко известной как «страж метаболизма». Этот фермент играет ключевую роль в регуляции энергетического гомеостаза и восстановлении митохондриального функционирования. Пока окончательное решение о дальнейшей разработке препарата не принято.
Мы начали обсуждение антивозрастных стратегий с укрепления иммунной системы, и логично завершить его рассмотрением противовоспалительных подходов — области, которая всё активнее входит в поле клинических испытаний.
Особый интерес вызывает семейство агонистов рецепторов GLP-1, изначально разработанных для лечения диабета 2 типа. Эксперименты на старых мышах показали, что эти препараты не только улучшают метаболические показатели, но и обратимо влияют на эпигенетические часы, особенно в области гипоталамуса. Эффект по эффективности оказался сопоставим с рапамицином. Помимо этого, GLP-1-аналогам уже удалось продемонстрировать снижение рисков заболеваний сердца и почек, а также подаются обнадёживающие сигналы в контексте модификации течения болезни Паркинсона и замедления прогрессирования болезни Альцгеймера.
Даже несмотря на то, что эти препараты не проникают напрямую через гематоэнцефалический барьер, всё больше данных указывает на то, что они могут подавлять воспаление в мозге через ось «кишечник–мозг» — потенциально один из базовых механизмов их нейропротективного действия.
Компания BioAge начала клиническое испытание, в котором оценивается комбинация GLP-1-аналогов с азелапрагом — синтетическим аналогом апелина, пептида, уровень которого с возрастом уменьшается, особенно в мышечной ткани. Целью этого исследования является проверка гипотезы о синергетическом эффекте и возможности реального продления здоровой жизни человека.
Будущее антивозрастной терапии: таргетирование воспаления
Помимо уже обсуждённых направлений, в фокусе антивозрастных исследований остаётся группа мощных противовоспалительных препаратов, способных модулировать ключевые механизмы старения. Одним из таких подходов стало ингибирование митоген-активируемой протеинкиназы (MAP). Препарат лосмапимод продемонстрировал значительное снижение воспаления кожи у пожилых людей, а также восстановление функции иммунных клеток кожи — особенно важного барьера в возрастном иммунитете.
Важно отметить большой потенциал блокаторов инфламмасомы NLRP3 — ключевого элемента в патогенезе хронического воспаления и возрастных заболеваний.
Другой перспективный путь связан с ингибированием сигнального каскада cGAS–STING (циклической GMP–AMP-синтазы и стимулятора интерфероногенеза), который играет центральную роль в воспалении стареющего мозга. В экспериментах на старых животных препараты, блокирующие этот путь, не только эффективно снижали воспалительные процессы в нескольких тканях, но и восстанавливали функциональную активность врождённых иммунных клеток.
Особый интерес вызывает также терапия антифибротической направленности. Возрастное развитие фиброза — патологического рубцевания тканей — ограничивает функцию органов и является одной из причин прогрессирующей полиорганной дисфункции. Современные клинические испытания тестируют новые соединения двойного действия, обладающие как антифибротическим, так и выраженным противовоспалительным потенциалом.
Наконец, среди нестандартных, но активно изучаемых подходов — модуляция кишечного микробиома как регулятора системного воспаления. Взаимосвязь между дисбалансом микрофлоры и хроническим воспалением делает эту стратегию особенно привлекательной как в профилактическом, так и в терапевтическом контексте.
Взгляд в Будущее
Преодоление старения — задача из разряда фундаментальных вызовов человечества. Но подтвердить эффективность антивозрастных технологий на людях — крайне сложно. Золотой стандарт в медицине — это крупные рандомизированные клинические исследования с плацебо и двойным слепым контролем. Однако в случае с омоложением это потребует десятилетий наблюдения. Ни одна из компаний, работающих в этой области, не готова инвестировать в столь масштабные и длительные испытания.
Вместо этого используются суррогатные маркеры — эпигенетические или протеомные «часы», способные указывать на биологический возраст, но не дающие уверенности в клиническом результате. Такие инструменты — это как стрелка на циферблате без механизма: они движутся, но не гарантируют, что время действительно идёт иначе.
Старение и рак: два лица одной медали
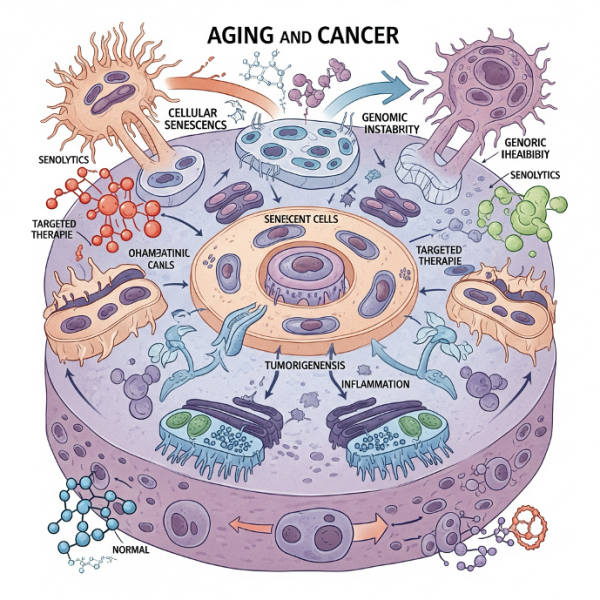
Парадоксально, но многие вмешательства, которые теоретически могли бы замедлить старение, несут в себе угрозу ускоренного развития рака. Это не случайность. Биологические механизмы старения во многом совпадают с механизмами канцерогенеза. Это и геномная нестабильность, и нарушения в эпигенетическом коде, укорочение теломер, сбои в утилизации белков, митохондриальные дефекты, воспаление, клеточный «мусор» и истощение стволового пула.
Стареющие (сенесцентные) клетки, к примеру, перестают делиться — это своеобразный встроенный антираковый щит. Но они же становятся источником хронического воспаления, выбрасывая сигнальные белки, усиливающие дегенеративные процессы. Сегодняшние препараты-сенолитики, уничтожающие такие клетки, выглядят перспективно, но не идеальны. Они не умеют различать «вредных» и «условно полезных» — и могут повреждать здоровые ткани.
Попытка «включить» аутофагию (внутриклеточную систему утилизации отходов), активизировать митохондрии или улучшить протеостаз может дать неожиданный побочный эффект — не только омолодить ткани, но и дать дополнительную энергию скрытому онкопроцессу.
А ещё одна ловушка — обобщённость эффектов. Например, частичное эпигенетическое перепрограммирование должно сработать мягко и повсеместно, но в реальности может вызвать гиперактивность в отдельных клетках — с риском перерождения. Аналогично, омоложение иммунной системы несёт риск пробуждения аутоиммунных заболеваний.
Это не повод отказываться от поиска решений. Но это предупреждение: в попытке продлить жизнь мы не должны забывать, что организм — не компьютер, где можно просто «откатить» к версии моложе. Это живой, сложно организованный механизм, где вмешательство в одну систему может иметь последствия во многих других.
Антивозрастная медицина находится в той точке, где надежды и опасности движутся бок о бок. И, возможно, главный показатель зрелости подхода к долголетию — это готовность видеть обе стороны этой медали.
Старение как непризнанный диагноз
Одним из ключевых тормозов в разработке лекарств и вмешательств, направленных на продление жизни, остаётся тот факт, что старение официально не считается заболеванием. Фармакологические регуляторы не видят в нём цели для терапии. Вспомним: до появления препаратов класса GLP-1 даже ожирение воспринималось скорее как особенность образа жизни, а не медицинская проблема. Всё изменилось, когда на рынке появились эффективные препараты, радикально преобразившие восприятие этого состояния. Возможно, подобное переосмысление ожидает и старение. Но ситуация здесь куда сложнее: ожирение — частное, старение — универсальное.
Обе эти категории объединяет одно — тесная связь с множеством хронических заболеваний. Однако доказательная база, связывающая замедление старения с предотвращением конкретных болезней, всё ещё крайне ограничена. Вероятно, именно профилактика отдельных возраст-ассоциированных заболеваний (например, деменции или атеросклероза) и станет первым рубежом признания: не как «таблетка от старости», а как шаг в её сторону.
Компрессия заболеваемости: теория без доказательств?
Существуют гипотезы, что продление жизни может сопровождаться так называемой «компрессией заболеваемости» — идеей, согласно которой продолжительность болезни в конце жизни уменьшается, а здоровый период увеличивается. Эту концепцию впервые сформулировал Джеймс Фрайс ещё в 1980-х. Он предположил, что идеальная кривая старения — это когда человек остаётся здоровым до самой старости, а затем буквально "сваливается со скалы" — умирает внезапно, не проходя через годы страданий.
Позже эту идею подхватил Питер Аттия в своей книге Outlive, где предложил «Медицину 3.0» — систему, направленную не на лечение болезней постфактум, а на активное продление полноценного, здорового периода жизни.
Куда более радикальную позицию занимает футуролог Рэй Курцвейл. Он утверждает, что первый человек, способный прожить тысячу лет, уже родился. Концепция «скорости ускользания от старения», о которой он писал в The Economist и своей книге Сингулярность всё ближе, заключается в том, что технологический прогресс однажды начнёт обгонять темпы старения организма. По его прогнозам, начиная с 2029 и до 2035 года, продолжительность жизни будет ежегодно расти на 12 месяцев. Иными словами, старение перестанет повышать риск смерти. Проблема лишь в одном: современная медицина пока и близко не обладает такой скоростью.
Долгая жизнь ≠ здоровая жизнь
Продолжительность жизни — это не то же самое, что продолжительность здоровой жизни. То, что мы умеем продлевать годы, ещё не значит, что мы умеем продлевать их качество. Идеальный сценарий, где человек бодро шагает в девятый десяток без деменции, онкологии, сердечно-сосудистых катастроф и дряхлости — это пока скорее мечта, чем реальность.
Найти убедительные доказательства такого сценария крайне сложно. Но это не означает, что он невозможен. Просто на пути к нему стоит недостаток данных, научная осторожность и неготовность системы здравоохранения воспринимать старение как модифицируемый процесс.
Здоровое долголетие: надежда, данные и реалистичный оптимизм
На сегодняшний день, пожалуй, единственным убедительным примером сжатия заболеваемости остаётся исследование долгожителей Новой Англии. Оно охватывало крайне редкую группу супердолгожителей — людей, достигших 110 лет и более, которые сохраняли физическое и когнитивное здоровье почти до самого конца жизни. Эти уникальные случаи показывают, что такое возможно — но пока остаются исключением, а не правилом.
Научное сообщество всё ещё не располагает надёжными доказательствами того, что старение человека можно безопасно и эффективно замедлить. Пока не доказано обратное, приходится исходить из предположения, что любые попытки увеличить продолжительность здоровой жизни скорее отодвигают наступление болезней, чем сокращают их длительность в целом.
Модуляция старения: возможность в горизонте

Тем не менее, оснований для сдержанного оптимизма становится всё больше. Например, есть основания полагать, что мы всё же увидим системное замедление старения организма. Уже сейчас формируется целая экосистема научных направлений — от биоинформатики до фармакогенетики — работающая над этой задачей. В ход идут колоссальные ресурсы, а ИИ становится важнейшим катализатором ускорения открытия новых препаратов.
Мы уже видели подобный прорыв: препараты GLP-1, несмотря на десятилетия разочарований, совершили революцию в лечении ожирения — одного из самых устойчивых вызовов современной медицины. И вполне возможно, что производные этих же соединений в будущем окажутся полезны и для продления здоровой жизни. Пока это область ожиданий, а не действительности. Но направление задано.
Ближайшее будущее: предупреждать, а не догонять
Где же мы действительно находимся на пороге перемен — так это в профилактике возрастных заболеваний. Мы входим в эру, когда сможем делать это чаще, раньше и точнее, чем когда-либо. Большинство заболеваний, связанных со старением, имеют долгий латентный период — от 10 до 20 лет до появления первых симптомов. Это даёт нам окно возможностей.
Современные инструменты — от биомаркеров и полигенных оценок риска до секвенирования генома, визуализации и мультимодальных ИИ-систем — открывают уникальный шанс не просто обнаруживать потенциальные риски, но делать это на ранних этапах жизни и с предсказанием вероятного времени манифестации болезни. Искусственный интеллект уже демонстрирует способность надёжно прогнозировать критические события в сложных биологических системах — а человек и есть такая система.
Точность и превенция: стратегия здоровья XXI века
Эта модель медицины — точного предсказания и индивидуального вмешательства — позволяет формировать персонализированные стратегии наблюдения и профилактики. Это могут быть корректировки образа жизни, усиленные постоянным мониторингом биомаркеров: от органоспецифичных белковых часов и внеклеточной опухолевой ДНК до воспалительных индикаторов, сигнатур микробиома или визуализированных изменений, вызывающих тревогу.
Пусть эта стратегия пока нова и требует клинического подтверждения, но она гораздо менее амбициозна — и в то же время более осуществима — чем попытки «переписать» сам механизм старения. И именно в этой реалистичной области мы можем ожидать наиболее ощутимых достижений уже в ближайшие годы.
Старение: между органами и системами
Сегодня граница между модуляцией старения всего организма и вмешательством в старение отдельных органов становится всё более размытой. Мы уже знаем, что препараты класса GLP-1 способны не только предотвращать диабет и сердечную недостаточность у пациентов с ожирением, но и оказывать благоприятное воздействие на целый ряд органов. Это можно рассматривать как системную пользу — множественный «бонус» к терапии, выходящий за пределы одной патологии.
Не исключено, что эти препараты влияют на сами механизмы старения, распространяя своё действие на весь организм. Ответ на этот вопрос мы ещё только получим. Но аналогичную многоуровневую динамику можно наблюдать и в других подходах — например, использование мощных противовоспалительных средств или частичное эпигенетическое перепрограммирование может быть направлено на конкретный орган, но при этом запускать изменения в системном биологическом возрасте.
Интересно и обратное: стратегия, ориентированная на общее омоложение организма, может на практике замедлить старение лишь одного — уязвимого — органа. В этом смысле органоспецифические вмешательства представляют собой более контролируемый, предсказуемый и безопасный путь. Они развивают уже существующую клиническую практику и снижают риски, связанные с чрезмерно агрессивными или экспериментальными вмешательствами на уровне всего организма.
Ведь если бы нам удалось эффективно предотвращать хотя бы ключевые возрастные заболевания — деменцию, рак, сердечно-сосудистые катастрофы, — это уже стало бы грандиозным достижением. И у нас есть все основания полагать, что это становится всё более реальной задачей.
Иммунная система — цель №1
И если выбирать один рубеж, где возможны самые захватывающие достижения в замедлении или предотвращении старения, то, как, вероятно, уже ясно, для меня такой целью является иммунная система. Она — страж и дирижёр нашего биологического возраста. Именно с неё, возможно, и начнётся настоящая эволюция долголетия.
До сих пор доминирует упрощённое представление: человек либо иммунокомпетентен, либо иммунокомпрометирован. На деле это не так. Нам отчаянно не хватает системного, количественного способа оценки состояния иммунной системы. Без этого мы вслепую: не знаем, как организм отреагирует на инфекцию, насколько уязвим к раку или склонен к развитию возрастных заболеваний — сердечно-сосудистых, нейродегенеративных, аутоиммунных.
Сегодня иммунный статус оценивают, как правило, по банальному общему анализу крови. Но подсчёт нейтрофилов и лимфоцитов — это как смотреть на айсберг, видя лишь его верхушку. Даже соотношение нейтрофилов к лимфоцитам, которое в высоких значениях считается неблагоприятным прогностическим фактором для выживаемости, чаще всего игнорируется в клинической практике.
Потенциал иммунотестов: уже известный, но недоступный
Ещё десять лет назад был продемонстрирован доступный метод за $25: с помощью капли крови можно было выявить экспозицию к более чем 1000 вирусам и их давность — в том числе к цитомегаловирусу, маркеру иммунного старения. Но тест так и не стал клинической реальностью.
А что, если бы мы могли периодически оценивать иммунную систему — так же, как следим за уровнем глюкозы или холестерина?
Одно из ярчайших исследований последнего десятилетия дало обнадёживающий ответ. На протяжении девяти лет отслеживали состояние иммунной системы у 135 здоровых людей — по клеточным популяциям (T, B, NK-клетки и их подтипы), экспрессии генов, цитокинам. Один из ключевых выводов: с возрастом снижается уровень цитотоксических CD8+ Т-клеток — причём скорость этого спада индивидуальна. Интересно, что иммунологические часы, построенные по этим данным, предсказывали смертность лучше, чем популярные эпигенетические часы.
iAge и другие иммуномы: оценка, прогноз, стратегия
Сегодня формируется целый класс новых биомаркеров — иммуномов. Один из них — iAge — основан на анализе цитокинов и хемокинов. Его значение растёт с возрастом и связано с дряхлостью, когнитивными нарушениями и числом хронических заболеваний. Примечательно, что у долгожителей (100+) этот показатель нередко ниже, чем у людей 50–70 лет.
Другой перспективный иммуном строится на анализе CD4+ и CD8+ Т-клеток, а также экспрессии ключевых генов. Он выявил подгруппу людей с наилучшей десятилетней выживаемостью — тех, кто обладал высокой иммунокомпетентностью и низким воспалением.
Наконец, совсем недавно предложен ещё один интегральный показатель иммунного здоровья. Он объединяет данные о белках плазмы, РНК-профиле, составе иммунных клеток и клинических параметрах, дополненных мультимодальным ИИ. Такая модель может выявлять признаки ускоренного иммунного старения даже у внешне здоровых людей и предсказывать силу антительного ответа на вакцины.
Infinity Bio и точная иммунология
Учёный Бен Ларман из Университета Джонса Хопкинса создал стартап Infinity Bio,который использует каплю крови на фильтровальной бумаге для анализа антител к более чем 500 вирусам, а также обнаружения сотен аутоантител. Технология использует панели белков с ДНК-штрихкодами — и потенциально открывает эру иммунного скрининга нового поколения.
Этот тест напоминает то, что обещал Theranos — но, в отличие от него, работает и развивается строго поэтапно. Пока доступен только для научных проектов, но в ближайшие годы может выйти на рынок для врачей и пациентов. Нам жизненно важно сделать такие инструменты доступными, недорогими и пригодными для рутинной клинической практики.
Почему это важно?
Иммунная система — не просто щит. Она — активный архитектор нашего здоровья и старения. Её функциональность определяет не только, подавим ли мы раковые клетки, но и как справимся с патологическим белковым агрегированием при болезни Альцгеймера, насколько эффективно сдержим воспаление в артериях и где начнётся сбой в самоузнавании.
Если бы мы могли регулярно составлять иммуном — карту состояния иммунной системы в реальном времени — это дало бы нам возможность отслеживать траекторию иммунного старения, выявлять критические точки и принимать индивидуализированные меры: от вакцинации и микробиомных вмешательств до терапии сенолитиками или эпигенетического перепрограммирования.
Но как и в любой мощной системе, баланс критичен. Избыточная стимуляция иммунитета может вызвать воспалительные каскады, цитокиновый шторм или аутоиммунные срывы. Возможно, именно здесь и кроется суть — в поиске точки иммунного равновесия, когда организм получает нужную силу защиты в нужное время и в нужной форме.
Именно это, кажется, и предписывает нам природа.
От реактивной к медицине предупреждения
Долгое время медицина оставалась реактивной. В лучшем случае — ориентированной на вторичную профилактику. Произошёл инфаркт — назначаются статины и аспирин, чтобы избежать повторного. У пациента с диабетом — контроль глюкозы и снижение уровня HbA1c. В онкологии мы действительно наблюдаем прогресс: всё меньше зависимости от токсичной химиотерапии, всё больше точечной терапии. Но всё же, в большинстве случаев диагностика по-прежнему запаздывает, а даже самые успешные методы лишь продлевают жизнь на месяцы.
Мы по-прежнему действуем постфактум. Но ситуация меняется.
Сегодня у нас появился шанс реализовать мечту медицины — первичную профилактику, когда болезнь не лечится, а предотвращается. И это — уже не теория, а возможность, находящаяся на расстоянии вытянутой руки.
Сценарий, который уже можно реализовать
Представим пожилого пациента с высоким риском сердечно-сосудистых заболеваний, которому пришлось сделать операцию по аорто-коронарному шунтированию. Уже в молодости ему можно было бы провести многоуровневую оценку индивидуального риска: генетика, образ жизни, маркеры воспаления, полигенные оценки. А затем — назначить продуманную стратегию профилактики: статины, коррекцию питания и физической активности, контроль за метаболическим статусом. В этом случае, вполне вероятно, пациент никогда бы не оказался на операционном столе, не перенёс бы инфаркт, и ему не потребовались бы стенты или шунтирование.
Сейчас у нас есть инструментарий, чтобы выстроить такую стратегию. Пять измерений данных, мультиомика, ИИ, биомаркеры и медицина образа жизни+, — всё это даёт реальный потенциал не только для замедления старения, но и для предотвращения большинства ведущих причин смерти.
Но вот где оптимизм сталкивается с реальностью
Перед тем как уйти в безудержный футуризм, стоит признать два фундаментальных барьера, которые могут поставить под угрозу весь прогресс.
Первый — глубокое неравенство в доступе к здравоохранению. Люди из маргинализированных сообществ, с низким доходом, живущие в загрязнённых районах, без доступа к качественному питанию — находятся в самой высокой группе риска. Но они же — и наименее охваченные всеми инновациями, которые обсуждаются в контексте цифровой биологии и медицины будущего.
Если долголетие и здоровье станут уделом исключительно богатых, то это — не научный триумф, а этический провал.
Второй — барьеры доступа к инновационным препаратам и вмешательствам. Яркий пример — препараты GLP-1. Они уже доказали свою эффективность в лечении ожирения и диабета, но остаются недоступными для подавляющего большинства тех, кому они жизненно необходимы.
В нашем распоряжении — историческая возможность. Цифровая биология может привести к экспоненциальным улучшениям в здравоохранении и профилактике, но только в том случае, если её плоды будут доступны всем.
Нам нужны государственно-частные партнёрства, которые бы делали такие препараты, как GLP-1, доступными либо бесплатно, либо по символической цене. Это стало бы образцом для будущих инноваций — от геномной терапии до ИИ-диагностики, от сенолитиков до персонализированных вакцин.
Парадокс прогресса: борьба за долголетие с оглядкой на отступление
Одна из самых серьёзных преград на пути к здоровому долголетию заключается в том, что мы, по сути, гоняемся за собственным хвостом. Как можно строить сверхинновационную медицину долголетия и одновременно закрывать глаза на всё то, что это долголетие укорачивает?
Мы говорим о продлении жизни с помощью ИИ, эпигенетики и сенолитиков, но почти ничего не делаем для борьбы с системными угрозами здоровью, которые уже повсеместны:
· растущее загрязнение воздуха;
· распространение микро- и нанопластика;
· повсеместное присутствие «вечных химикатов» PFAS;
· обилие ультраобработанных продуктов в рационе;
· ухудшение качества воды и экологических условий жизни.
Все эти факторы можно объединить в категорию «образ жизни+» — расширенную рамку, в которую включены не только поведенческие привычки, но и среда, в которой мы живём, дышим и пьем.
Угроза изнутри: антинаука как системный риск
Неменьшую опасность представляет и дезинформация, которая распространяется со скоростью вируса. Теории заговора, антинаучные нарративы, отказ от экспертного знания — всё это подрывает доверие к науке и тормозит внедрение важнейших открытий в биомедицине. Бороться с этим можно только одним способом — восстановлением доверия. Доверия к экспертам, к институциям, к самой идее доказательности.
Когда мы говорим о подавлении возрастных заболеваний — это кажется фантастикой. Но вспомним первый год пандемии COVID-19. Вакцин не было, пожилые люди умирали чаще всего. Но те, кто дождался вакцинации, получили надёжную иммунную защиту — не от самой болезни, а от одной лишь её молекулы — и выжили.
Та же логика применима и здесь. Нам нужно «дождаться» цифровой биологии — но, чтобы быть к этому готовы, мы должны уже сегодня поддерживать организм в состоянии здоровья. И делать это не просто через отказ от вредных привычек, а через осознанное управление образом жизни+: питанием, сном, экологией, психическим здоровьем, физической активностью, средой и информацией.
Подавление возрастных заболеваний — не утопия, а следующая ступень. Но путь к ней начинается не с лаборатории, а с того, что на нашей тарелке, в нашем воздухе и в нашей ленте новостей. Без устранения базовых вредных факторов и без восстановления доверия к науке — вся архитектура прогрессивного долголетия будет построена на песке.
Только тогда, когда забота о здоровье перестанет быть элитным проектом, а станет новой нормой — мы сможем с уверенностью вступить в эпоху программируемой биологии и управляемого старения.
Эпоха цифровой биологии: биология как инженерия
Сегодня мы стоим на пороге новой парадигмы. Как сказал Дженсен Хуанг, генеральный директор NVIDIA: «Впервые в истории человечества биология становится инженерией, а не просто наукой». Хотя, справедливости ради, она остаётся и тем, и другим.
То, как мы можем спроектировать здоровое старение — предупредить болезни, связанные с возрастом, — стало возможным благодаря стремительному развитию наук о жизни за последние несколько лет. Революция, которую мы наблюдаем в генеративном ИИ, находит своё отражение и в биологии: здесь тоже начинается экспоненциальный рост.
Один из примеров — платформа Evolutionary Scale от исследователей Meta. Она представляет собой языковую модель для белков, обученную на 2,7 миллиарда последовательностей, с предсказанием их структуры и функций. Мы действительно движемся к состоянию, где биология становится программируемой.
Биотехнологический взрыв
Мы живём в поистине беспрецедентное время. На наших глазах, синхронно, развиваются:
· генная инженерия и редактирование ДНК;
· технологии контроля иммунной толерантности;
· методы раннего выявления онкологических и нейродегенеративных заболеваний через критические биомаркеры;
· клеточная инженерия;
· доставка терапевтических агентов с помощью мРНК и наночастиц.
Все эти прорывы происходят одновременно, усиливая друг друга. Это уникальный момент в истории биомедицины — синергия скорости, глубины и технологической зрелости.
Бессмертие или вожделенная вечеринка?

Мы, смертные, выбираем поступки, полагая, что наше пребывание в бренном мире подойдет к концу в обозримом будущем. Поэтому мы имеем возможность рисковать – взбираться на высокие горы, плавать в океане или просто переходить автомобильную дорогу и поужинать в незнакомом ресторане. Будучи бессмертными, мы вряд ли бы отважились на какие-либо рискованные поступки, поскольку они сопряжены с потерей вечной жизни.
Тогда возьмем менее амбициозную цель, такую, как, например, удвоить продолжительность жизни. И это вполне реально: в ХХ веке мы почти удвоили среднюю продолжительность жизни с 40 до 75 лет, так почему бы не попробовать увеличить ее, скажем, до 150 лет. Даже такой прогресс революционизировал бы наше сознание и существование. Возьмем, к примеру, семейные институты, взаимоотношения между супругами, связь между родителями и детьми. Сегодня мы влюбляемся лет в 25, затем идем к алтарю, подразумевая, что будем идти рука об руку до конца жизни. Самую активную часть семейной жизни мы посвящаем детям. Продолжительность жизни в 150 лет подразумевает, что семейная жизнь продлится 125 лет, значительная часть из которых пройдет вне воспитания детей. Насколько это реалистично и правильно?
Другой пример – трудовая карьера. Сегодня большинство из нас учится профессии в молодости (20–30-летнем возрасте) и посвящает ей всю сознательную жизнь по крайней мере до пенсии, то есть в течение 30–40 лет. Продолжительность жизни в 150 лет наряду с внедрением новых технологий создает уникальные возможности для творческой самореализации в самых разных профессиях, даже когда нам под 100 лет и больше. Это позволит умудренных опытом старцев не только быть наставниками в своей профессии, но и делиться новыми идеями и самим реализовывать инновации с перспективой видеть их результаты в обозримом будущем.
В рассказе «Бессмертный» аргентинского писателя Хорхе Луиса Борхеса римский воин натыкается во время похода на «секретную реку, дарующую бессмертие». Выпив из нее и проведя годы в глубоких размышлениях, он понимает, что смерть все же придает жизни ценность, в то время как для бессмертных «все повторяется, и ничто не может быть потеряно». Римлянин тысячу лет скитается по планете преисполненный решимости найти противоядие от вечной жизни. Однажды, будучи на побережье Эритреи, он выпивает из источника с чистой водой и ощущает укол колючего дерева. Встревоженный незнакомым чувством боли, но поняв, что к нему вернулась смертность, он безмолвно и радостно наблюдает за каплей крови, медленно скатывающейся по его коже.
Как-то группу студентов попросили сделать выбор. Первый таков: вы бессмертны, но это условие исключает любовь, зачатие, беременность, воспроизводство и так далее. Выбор второй: вы живете до 85 лет и, ни разу не заболев, в одно утро не просыпаетесь. Абсолютное большинство опрошенных сделало второй выбор, объяснив это следующим. Жизнь – это как вечеринка, которая имеет начало и когда-то заканчивается. Мы знаем, что вечеринка продлится лишь несколько часов, и стремимся ее не пропустить, получив на ней максимум удовольствия. Представим себе, что вечеринка никогда не заканчивается, и вы имеете возможность попасть туда в любое время, когда захотите – завтра, через месяц, несколько месяцев и лет – к ней мгновенно теряется интерес.
Желание сохранить жизнь во всей ее красоте и проявлениях является многовековой мечтой человечества. Мы стремимся помолодеть или остаться такими, как есть, на долгие годы, ну хотя бы немного дольше – до тех пор, пока не придется уйти навсегда.
Основные литературные источники использованные в данной публикации
- Alpert, Ayelet, et al. A clinically meaningful metric of immune age derived from high-dimensional longitudinal monitoring. Nature Medicine, 25(3), 487–495. (2019).
https://doi.org/10.1038/s41591-019-0381-y - Attia, Peter. Outlive: The Science and Art of Longevity. Harmony Books, New York. (2024).
ISBN: 9780593236598 - Dohm-Hansen, Sebastian, et al. The 'middle-aging' brain. Trends in Neurosciences, 47(4), 259–272. (2024). https://doi.org/10.1016/j.tins.2024.02.001
- Emilsson, Valur, et al. Predicting health and life span with the deep plasma proteome.Nature Medicine, 25(12), 1815–1826. (2019). https://doi.org/10.1038/s41591-019-0677-y
- Fries, James F. The compression of morbidity. Annals of the Academy of Medicine, Singapore, 12(3), 358–367. (1983). PMID: 6356809
- Horvath, Steve, et al. Digitising the ageing process with epigenetic clocks.
Lancet, 404(10451), 423. (2024). https://doi.org/10.1016/S0140-6736(24)01554-x - Lopez-Otín, Carlos, et al. Hallmarks of aging: An expanding universe.
Cell, 186(2), 243–278. (2023). https://doi.org/10.1016/j.cell.2022.11.001 - Moore, Steven C., et al. Leisure time physical activity of moderate to vigorous intensity and mortality: A large pooled cohort analysis. PLOS Medicine, 9(11): e1001335. (2012).https://doi.org/10.1371/journal.pmed.1001335
- Oh, Hamilton Se-Hwee, et al. Organ aging signatures in the plasma proteome track health and disease. Nature, 624(7990), 164–172. (2023). https://doi.org/10.1038/s41586-023-06802-1
- Oh, Hamilton Se-Hwee, et al. Plasma proteomics in the UK Biobank reveals youthful brains and immune systems promote healthspan and longevity. bioRxiv. (2024, June).https://doi.org/10.1101/2024.06.01.593791 (preprint)
- Sakanikawa, Ryoto, et al. Impact of modifiable healthy lifestyle adoption on lifetime gain from middle to older age. Age and Ageing, 51(5). (2022).https://doi.org/10.1093/ageing/afac080
- Singh, Param Priya, et al. The genetics of aging: A vertebrate perspective.
Cell, 177(1), 200–220. (2019). https://doi.org/10.1016/j.cell.2019.02.038 - Sparks, Rachel, et al. A unified metric of human immune health. Nature Medicine. (2024, July). https://doi.org/10.1038/s41591-024-03092-6
- Topol, Eric. Super Agers: An Evidence-based Approach to Longevity. Simon & Shuster. 2025