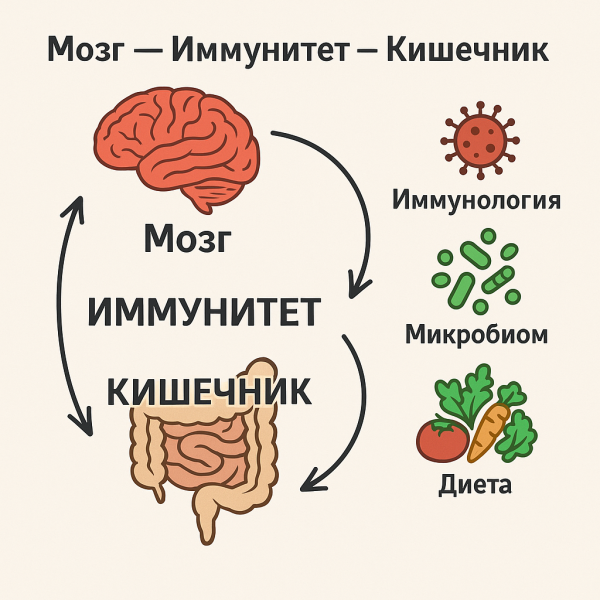
Ось «Мозг — Иммунитет — Кишечник»: Новая концепция нейродегенерации через призму иммунологии, микробиома и питания
РЕЗЮМЕ
Нейродегенеративные заболевания, традиционно интерпретировавшиеся преимущественно как патологии, обусловленные нарушением процессов протеостаза и прогрессирующей гибелью нейронов, в настоящее время всё более признаются системными иммунометаболическими синдромами. Концепция мозга как иммунологически привилегированного органа, изолированного от периферических иммунных влияний, была радикально пересмотрена в свете открытий глимфатической системы, менингеальных лимфатических сосудов, а также прямых механизмов нейроиммунного взаимодействия. Эти данные убедительно демонстрируют функциональную интеграцию центрального и периферического звеньев иммунитета. Внутри центральной нервной системы ключевым медиатором этих процессов выступает микроглия, обладающая дуалистической природой: с одной стороны, она осуществляет нейропротективные функции, с другой — может инициировать и поддерживать патологические каскады. Генетические предикторы, такие как аллель APOE4 и мутации в гене TREM2, подтверждают патогенетическую значимость врождённой иммунной дисфункции в развитии болезни Альцгеймера и других форм нейродегенеративных деменций.
Экстрацеребральные компоненты иммунной регуляции, включая кишечную лимфоидную ткань (GALT) и кишечный микробиом, играют определяющую роль в поддержании системного иммунного гомеостаза. Механизмы данной регуляции реализуются через продукцию микробных метаболитов, модификации пула желчных кислот и модуляцию афферентных сигналов по блуждающему нерву. Старение организма оказывает аддитивное патологическое воздействие, ускоряя процессы иммунного старения и способствуя феномену «инфламэйджинга» — хронического низкоуровневого воспаления, связанного с возрастом, которое подрывает синаптическую пластичность и устойчивость нейрональных сетей.
Диетологические и нутриентные факторы представляют собой значимые модифицируемые детерминанты функционирования оси «Мозг — Иммунитет — Кишечник». Так, пищевые волокна, полифенольные соединения и длинноцепочечные омега-3 полиненасыщенные жирные кислоты способствуют формированию иммунной толерантности и обладают выраженными нейропротективными свойствами, тогда как ожирение и ассоциированные метаболические нарушения индуцируют хроническое нейровоспаление. Современные терапевтические стратегии включают интервенции, направленные на целенаправленную модуляцию микробиома, применение агонистов рецептора GLP-1, методы биоэлектронной нейромодуляции, а также подходы, ориентированные на омоложение иммунной системы. Эти направления подчеркивают высокий трансляционный потенциал формирующейся иммунометаболической парадигмы.
Таким образом, совокупность имеющихся данных позволяет рассматривать ось «Мозг — Иммунитет — Кишечник» в качестве ключевого интегративного детерминанта патогенеза нейродегенеративных заболеваний. Перспективы дальнейших исследований заключаются в углублённом изучении механизмов иммунной регуляции, микробной экологии и диетологических влияний с целью разработки инновационных профилактических и терапевтических подходов.
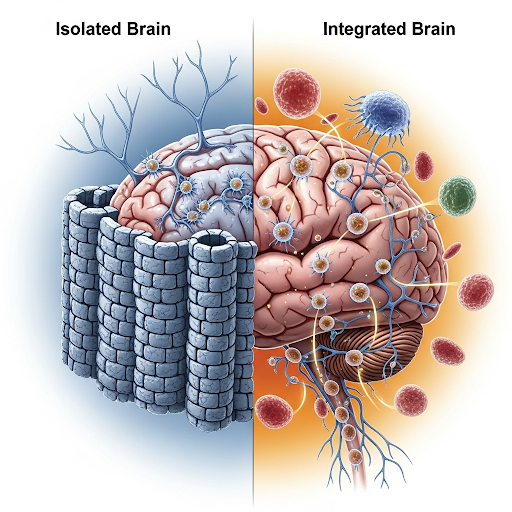
От иммунной привилегии к иммунной интеграции
На протяжении значительной части XX века центральная нервная система (ЦНС) рассматривалась как иммунологически привилегированный орган, защищённый от периферического иммунного надзора гематоэнцефалическим барьером (ГЭБ). Ранние эксперименты по трансплантации и клинические наблюдения казались убедительным подтверждением этой концепции: трансплантаты демонстрировали более длительное выживание в мозге по сравнению с периферическими тканями, а энцефалит интерпретировался исключительно как следствие нарушения целостности ГЭБ [1–6]. В этой парадигме ЦНС представлялась своеобразным «островом» нейрональной активности, изолированным от нестабильных и потенциально разрушительных влияний иммунной системы.
Ситуация радикально изменилась после накопления данных, свидетельствующих о наличии иммунных клеток и цитокинов в спинномозговой жидкости, а также вслед за открытием менингеальных лимфатических сосудов и прямых каналов костного мозга, соединяющих свод черепа с твердой мозговой оболочкой. Эти открытия убедительно показали, что мозг не является иммунологически изолированным органом, а находится в постоянном взаимодействии с периферическими звеньями иммунной системы. В настоящее время известно, что иммунные клетки патрулируют менингеальные пространства, дендритные клетки осуществляют презентацию антигенов, дренируемых из паренхимы, а микроглия функционирует в качестве резидентного «иммунного стража» внутри самой ЦНС. ГЭБ, ранее трактовавшийся как непроницаемая «крепость», рассматривается сегодня как динамический регулирующий интерфейс, обеспечивающий селективный обмен цитокинами, хемокинами и метаболитами, которые определяют как нейрональный гомеостаз, так и системное иммунное равновесие [7–17].
Последствия данного концептуального сдвига имеют фундаментальное значение. ЦНС перестаёт пониматься как иммунологически «неприкосновенный» орган; напротив, она интегрирована в единую системную иммунную сеть. В этой связи нейродегенеративные заболевания всё чаще рассматриваются не как изолированные неврологические дисфункции, а как состояния, в основе которых лежат дисрегулированные иммунные взаимодействия.
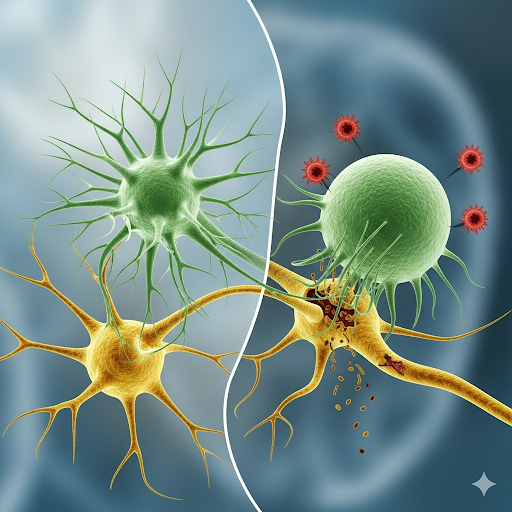
Микроглия: стражи и медиаторы патологии
Микроглия, представляющая собой резидентную популяцию макрофагов центральной нервной системы, играет принципиально двойственную роль в поддержании и нарушении нейронального гомеостаза. В период развития она обеспечивает формирование синаптических связей посредством процессов «синаптической обрезки» и трофической поддержки нейрональных сетей. У взрослого организма микроглиальные клетки функционируют как сенсоры повреждения, реагируя на патогенные агенты, травматические воздействия и накопление аномальных белковых агрегатов. Однако в условиях старения или при наличии генетической предрасположенности микроглия способна переходить в дисфункциональное, патогенное состояние. Такая «перепрограммированная» микроглия характеризуется накоплением липидных капель, гиперпродукцией провоспалительных цитокинов, генерацией активных форм кислорода и аномальной фагоцитарной активностью, приводящей к неадекватному удалению синапсов, что в совокупности способствует ускоренному когнитивному снижению [18–24].
Генетические исследования подтверждают ключевую роль микроглии в патогенезе нейродегенеративных заболеваний. Варианты генов TREM2, APOE, CD33 и других иммунорегуляторных локусов устойчиво выявляются в полногеномных исследованиях ассоциаций при болезни Альцгеймера. Наиболее изученный аллель APOE4 оказывает выраженное влияние на метаболизм микроглиальных клеток, усиливая их воспалительные ответы на β-амилоид и тау-белок и снижая эффективность фагоцитарного клиренса. Накопленные данные свидетельствуют о причинной, а не лишь коррелятивной роли этих иммунных путей, что открывает возможность для терапевтической модуляции микроглиальной активации как стратегии изменения траектории заболевания [25–30].
Таким образом, микроглия перестаёт рассматриваться как пассивный свидетель протеинопатии: напротив, она выступает активным медиатором, определяющим динамику прогрессирования нейродегенеративных процессов. Выявление молекулярных «переключателей», регулирующих переход микроглии от защитного к патогенному фенотипу, в настоящее время представляет собой одну из ключевых задач нейроиммунологии.
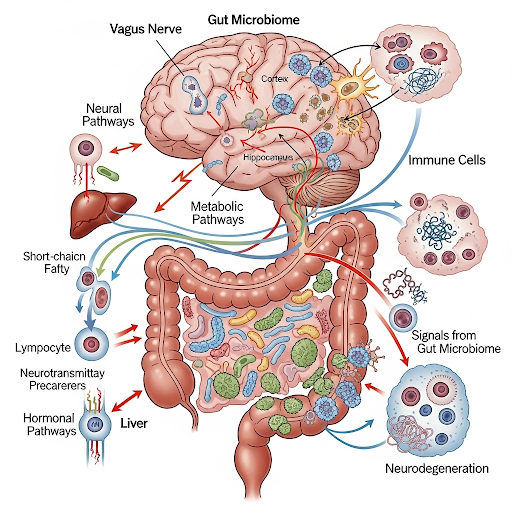
Ось «Кишечник — Мозг — Иммунитет»
Параллельно с развитием иммунологии центральной нервной системы стало очевидно, что кишечник играет ключевую роль в регуляции мозгового гомеостаза и нейровоспалительных процессов. Лимфоидная ткань, ассоциированная с кишечником (GALT), является крупнейшим иммунным органом организма, включающим пейеровы бляшки, мезентериальные лимфатические узлы и иммунные клетки собственной пластинки слизистой оболочки. Она определяет системный воспалительный фон и формирует популяции лимфоцитов, обладающих способностью мигрировать в головной мозг. Нарушения проницаемости кишечного барьера, возникающие при дисбиозе и ряде системных патологий, ведут к повышенному поступлению микробных антигенов и метаболитов в системный кровоток и, как следствие, к их проникновению в ЦНС [31–38].
Микробиота придаёт этой оси дополнительное функциональное измерение. Микроорганизмы кишечника синтезируют широкий спектр метаболитов, включая короткоцепочечные жирные кислоты (КЦЖК), производные желчных кислот, метаболиты триптофана и липополисахариды, обладающие выраженными иммуномодулирующими свойствами. Так, бутират и другие КЦЖК усиливают активность регуляторных Т-лимфоцитов и снижают про-воспалительную активацию микроглии. В противоположность этому, бактериальные амилоиды и эндотоксины способны индуцировать микроглиальные клетки в патологически активированный фенотип. Данные доклинических исследований демонстрируют, что истощение микробиоты изменяет характер β-амилоидной депозиции, модулирует синаптическую пластичность и влияет на поведенческие фенотипы, включая двигательные функции. Таким образом, кишечник выступает как своеобразная «тренировочная площадка» иммунных реакций и одновременно как усилитель системных иммунных сигналов, определяющих функциональное состояние головного мозга [39–47].
Помимо иммунных и метаболических механизмов, существенное значение имеет нейрональный канал связи, обеспечиваемый блуждающим нервом. Его афферентные волокна, иннервирующие кишечник, передают в головной мозг информацию о микробных метаболитах, воспалительных сигналах и механических характеристиках пищеварительного тракта. Экспериментальные данные подтверждают, что активация вагусных путей может снижать нейровоспаление и модулировать поведенческие реакции, в том числе связанные с тревогой и когнитивными функциями. Таким образом, блуждающий нерв представляет собой ключевой нейрональный медиатор, интегрирующий сигналы от кишечника в регуляцию мозгового иммунного статуса.
Не менее важным является эндокринный компонент оси «Кишечник — Мозг». Кишечные энтероэндокринные клетки секретируют широкий спектр гормонов и нейропептидов — включая GLP-1, GIP, PYY, грелин и серотонин кишечного происхождения — которые способны воздействовать как напрямую на нейроны мозга, так и опосредованно через модуляцию иммунных клеток. GLP-1, в частности, демонстрирует нейропротективные и противовоспалительные свойства, что делает его перспективной терапевтической мишенью при нейродегенеративных заболеваниях. Дополнительно показано, что микробные метаболиты могут регулировать секрецию этих гормонов, усиливая тем самым интеграцию метаболической, иммунной и нейрональной сигнализации.
В совокупности данные наблюдения позволяют трактовать кишечник как мультифункциональный орган, осуществляющий модуляцию мозговых функций посредством трёх взаимосвязанных каналов — иммунного, нейронального и эндокринного. Такая интегративная перспектива формирует современное понимание оси «Кишечник — Мозг — Иммунитет» как критического регуляторного узла патогенеза нейродегенеративных заболеваний.
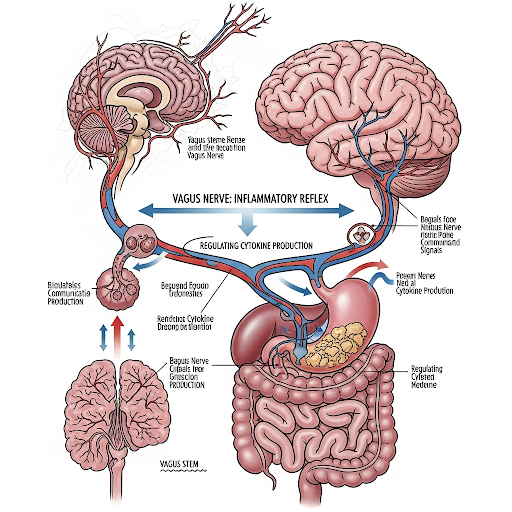
Нервные цепи и воспалительный рефлекс
Диалог между кишечником и центральной нервной системой не сводится исключительно к обмену метаболитами. Существенную роль играют нервные цепи, среди которых ключевое место занимает блуждающий нерв, обеспечивающий двунаправленную коммуникацию между кишечными сигналами и ядрами ствола мозга. В этом контексте особое значение приобретает феномен «воспалительного рефлекса», представляющего собой нейрональный механизм регуляции продукции цитокинов, который действует как физиологический «тормоз», предотвращая избыточную активацию иммунной системы. Экспериментальные данные свидетельствуют, что стимуляция вагусных путей способна подавлять высвобождение фактора некроза опухоли (ФНО), оказывать терапевтический эффект при воспалительных заболеваниях кишечника и снижать патологическую активацию микроглии в головном мозге [48–54].
Не менее важную роль играет энтеральная нервная система (ЭНС), часто обозначаемая как «второй мозг». Она обеспечивает локальную интеграцию диетических и микробных сигналов и формирует функциональный интерфейс между кишечной средой и центральными регуляторными структурами. Энтероэндокринные клетки кишечника детектируют микробные метаболиты и транслируют полученные сигналы как нейронам ЭНС, так и афферентным волокнам блуждающего нерва. Новые экспериментальные данные указывают на то, что отдельные бактериальные метаболиты могут оказывать влияние на мотивацию к физической активности, активируя специфические сенсорные пути от кишечника к мозгу.
Эти наблюдения подчёркивают исключительную широту функционального воздействия оси «Кишечник — Мозг — Иммунитет», охватывающую не только регуляцию иммунного тонуса, но и поведенческие фенотипы [55–58]. В совокупности данные факты свидетельствуют о существовании сложной многоуровневой сети, в рамках которой иммунные медиаторы, микробные метаболиты и нейрональные рефлексы совместно формируют воспалительный микроклимат головного мозга и определяют его устойчивость к нейродегенеративным процессам.
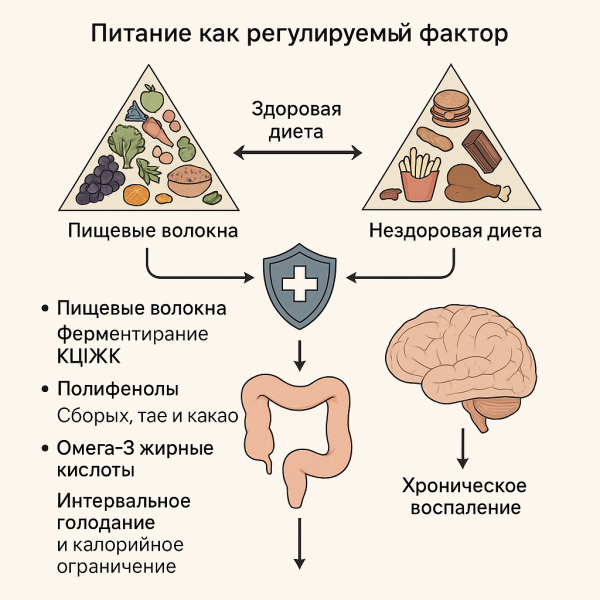
Питание как регулируемый фактор
Питание представляет собой один из наиболее мощных и одновременно модифицируемых факторов, влияющих на функционирование оси «Кишечник — Иммунитет — Мозг». Эпидемиологические и когортные исследования убедительно демонстрируют, что соблюдение средиземноморской диеты и диеты MIND ассоциировано со снижением риска когнитивного снижения и болезни Альцгеймера. Эти пищевые модели характеризуются высоким содержанием растительных продуктов, пищевых волокон, полифенолов и длинноцепочечных омега-3 полиненасыщенных жирных кислот при минимальном употреблении рафинированных сахаров и насыщенных жиров [59–68].
Механистические исследования раскрывают молекулярные и клеточные пути, опосредующие эти эффекты. Пищевые волокна подвергаются ферментации кишечной микробиотой с образованием короткоцепочечных жирных кислот (КЦЖК), которые способствуют дифференцировке регуляторных Т-клеток и поддержанию целостности гематоэнцефалического барьера. Полифенолы, содержащиеся в ягодах, чае и продуктах из какао, модулируют сигнальные каскады NF-κB и способствуют обогащению микробных сообществ, ассоциированных с противовоспалительным фенотипом. Омега-3 жирные кислоты улучшают синаптическую функцию, инициируют резолюцию воспаления посредством специализированных липидных медиаторов и ограничивают чрезмерную активацию микроглии. Дополнительно, стратегии калорийного ограничения и интервального голодания демонстрируют способность перепрограммировать иммунный ответ, снижая уровень системного воспаления и повышая устойчивость к аутоиммунным процессам [69–74].
В противоположность этому, диеты, способствующие развитию ожирения, индуцируют хроническое системное воспаление, метаболическую дисфункцию и повышенную проницаемость гематоэнцефалического барьера. Совокупность этих изменений ускоряет когнитивное снижение и повышает уязвимость к нейродегенеративным процессам [75–79].
Клинические интервенции и терапевтические перспективы
Современные подходы в нутрициональной медицине стремятся использовать потенциал диетических факторов как мишеней для профилактики и терапии нейродегенеративных заболеваний. Наибольший интерес представляют три направления:
1. Пробиотики — живые микроорганизмы, способные восстанавливать баланс микробиоты и снижать выраженность воспалительных процессов. Клинические исследования показали, что некоторые штаммы Lactobacillus и Bifidobacterium уменьшают уровень системных провоспалительных цитокинов и положительно влияют на когнитивные показатели у пожилых пациентов.
2. Пребиотики — неперевариваемые компоненты пищи (например, инулин, галактоолигосахариды), которые стимулируют рост и метаболическую активность благоприятных кишечных бактерий. Их применение способствует увеличению продукции КЦЖК и улучшению барьерной функции кишечника, что опосредованно снижает нейровоспаление.
3. Нутрицевтики — концентрированные формы биологически активных веществ (полифенолы, омега-3 жирные кислоты, витамины группы B, витамин D), обладающие доказанными противовоспалительными и нейропротективными свойствами. Так, добавки омега-3 ассоциированы с улучшением когнитивных функций, а полифенольные комплексы (например, ресвератрол) модулируют сигнальные пути воспаления и окислительного стресса.
Несмотря на возрастающее количество обнадёживающих данных, остаётся необходимость в масштабных рандомизированных клинических исследованиях для уточнения эффективности и оптимальных протоколов применения пробиотиков, пребиотиков и нутрицевтиков. Их использование в составе комплексных стратегий может открыть новые возможности для индивидуализированной профилактики и замедления прогрессирования нейродегенеративных заболеваний.
Терапевтические границы
Интеграция достижений нейроиммунологии и науки о микробиоме открыла новые направления в разработке терапевтических стратегий для профилактики и лечения нейродегенеративных заболеваний. Интервенции, направленные на модификацию микробиоты — включая пробиотики, пребиотики, синбиотики и постбиотики, — в настоящее время активно исследуются с целью оценки их способности изменять микробное сообщество кишечника и снижать нейровоспалительные процессы. Результаты ранних клинических испытаний свидетельствуют о возможных умеренных когнитивных преимуществах, однако механистические основы этих эффектов остаются предметом дальнейшего изучения [80–86].
Не менее стремительно развиваются фармакологические подходы. Особое внимание привлекают агонисты рецептора GLP-1, изначально созданные для терапии сахарного диабета, которые продемонстрировали нейропротективные эффекты в доклинических и клинических исследованиях болезни Альцгеймера и болезни Паркинсона. Их действие, по-видимому, реализуется через противовоспалительные и метаболические механизмы. Биологические препараты, нацеленные на отдельные иммунные звенья, такие как анти-ФНО-терапия, также находятся на стадии клинической апробации, хотя сохраняются нерешённые вопросы, касающиеся специфичности и безопасности. Появляющиеся данные о роли таких факторов, как фактор 4 тромбоцитов, формируют новые представления о перспективах омоложения иммунных сетей, утрачивающих функциональную пластичность с возрастом [87–92].
Параллельно с этим формируется направление устройственных стратегий, в основе которых лежит модуляция нервно-иммунных цепей. Так, стимуляция блуждающего нерва и транскраниальная стимуляция переменным током продемонстрировали в предварительных исследованиях способность изменять иммунный тонус и улучшать когнитивные показатели. Эти подходы формируют основу для развития концепции «биоэлектронной медицины», ориентированной на высокоточное восстановление нарушенного нейроиммунного баланса [93–96].
Таким образом, современный терапевтический ландшафт характеризуется стремительным расширением границ — от нутрициологических и микробиом-ориентированных стратегий до фармакологических и биоэлектронных вмешательств. Их интеграция в будущем может заложить основу для персонализированных программ профилактики и лечения нейродегенеративных заболеваний.
Заключение
Накопленные за последние десятилетия данные коренным образом изменили представления о взаимодействии иммунной системы и головного мозга. Концепция «иммунной привилегии» уступила место модели иммунной интеграции, согласно которой ЦНС включена в динамическую сеть системного иммунного надзора и обмена сигналами. Гематоэнцефалический барьер, ранее считавшийся непроницаемой «крепостью», ныне рассматривается как регулирующий интерфейс, обеспечивающий двусторонний обмен медиаторами между мозгом и периферией.
В этой системе особое место занимает микроглия — резидентные иммунные клетки мозга, обладающие двойственной природой. Они могут выполнять как протективные, так и патогенные функции, определяя исходы нейродегенеративных процессов. Генетические исследования (TREM2, APOE, CD33 и др.) подтвердили причинную значимость микроглиальной дисфункции, что делает её мишенью для будущих терапевтических стратегий.
Наряду с этим, ось «Кишечник — Мозг — Иммунитет» выявилась как один из центральных регуляторных узлов в поддержании когнитивного здоровья. Кишечный микробиом и лимфоидная ткань GALT модулируют иммунный тонус, формируют популяции клеток, способных мигрировать в ЦНС, и обеспечивают постоянный поток метаболитов, влияющих на микроглию и нейрональную функцию. Дополнительное измерение вносит нейрональная и эндокринная связь: блуждающий нерв, энтероэндокринные клетки и кишечные гормоны интегрируют метаболические и микробные сигналы в регуляцию мозгового иммунного статуса.
Питание в этой интегративной системе выступает наиболее мощным и при этом модифицируемым фактором. Диетические модели, основанные на растительных продуктах, пищевых волокнах, полифенолах и омега-3 жирных кислотах (например, средиземноморская диета, диета MIND), ассоциированы с более низким риском когнитивного снижения. В то же время калорийное ограничение и интервальное голодание демонстрируют потенциал в перепрограммировании иммунных реакций и снижении хронического воспаления. Противоположный полюс занимают про-обезогенные диеты, индуцирующие системное воспаление, нарушение барьерных функций и ускоренное нейродегенеративное старение.
В совокупности эти данные позволяют рассматривать нейродегенеративные заболевания не как линейный каскад нарушений протеостаза, а как результат системной дисрегуляции иммунного и метаболического взаимодействия, формируемого на стыке генетических предрасположенностей, возраста и факторов окружающей среды. Практическая значимость этого сдвига заключается в том, что он открывает новые терапевтические рычаги: от модуляции микробиоты, нутрицевтических и диетических вмешательств до иммунного профилирования и таргетированной нейромодуляции.
Следующее десятилетие, вероятно, станет временем пересмотра профилактических и терапевтических стратегий в области нейродегенеративных заболеваний. Смещение акцента в сторону прецизионного питания, интегративных подходов и стратегий омоложения иммунной системы позволит не только отсрочить прогрессирование патологии, но и принципиально изменить парадигму сохранения когнитивного здоровья. Рассматривая мозг как часть более широкой иммунометаболической экосистемы, мы открываем новые горизонты в понимании и лечении нейродегенерации.
Список литературы
1. Galea, I., Bechmann, I., & Perry, V. H. (2007). Revisiting the concept of CNS immune privilege. Trends in Immunology, 28(10), 503–510. https://doi.org/10.1016/j.it.2007.08.006
2. Medawar, P. B. (1948). The immunity of homologous grafted skin; the fate of skin homografts transplanted to the brain and anterior chamber of the eye. British Journal of Experimental Pathology, 29(1), 58-69.
3. Kiernan, J. A. (2012). Blood-brain barrier. Encyclopedia of Neuroscience, 687–690.
4. Olsen, A. L., & Fahey, J. (2006). Correlation Between Breakdown of the Blood-Brain Barrier and Disease Progression in Viral Encephalitis in Mice. Journal of General Virology, 87(7), 1967–1974.
5. Wilbanks, G. A., & Streilein, J. W. (1991). Site-specific immunity and the concept of immune privilege. The Journal of Experimental Medicine, 173(3), 619–622.
6. Galea, I. (2021). A privileged brain. Science, 374(6566), 27–29.
7. Louveau, A., Smirnov, I., Keyes, T. J., Eccles, J. D., Rouhani, S. J., Derecki, N. C., … & Kipnis, J. (2015). Structural and functional features of central nervous system lymphatic vessels. Nature, 523(7560), 337–341. https://doi.org/10.1038/nature14432
8. Perez, J. M., McBride, E., Cugurra, A., & Prinz, M. (2023). Skull bone marrow channels as immune gateways to the central nervous system. Trends in Neurosciences, 47(1), 43–55. https://doi.org/10.1016/j.tins.2023.10.003
9. Liu, L., Li, X., Peng, Z., Wu, Y., Leong, K. W., & Shi, Y. (2025). Skull bone marrow and skull meninges channels in neuroinflammation. Cell Death & Disease, 16, Article 7336. https://doi.org/10.1038/s41419-025-07336-2
10. Hershenhouse, K. S., & Yoon, B. (2019). Meningeal lymphatics: a review and future directions. Frontiers in Neurology, 10, 1459. https://doi.org/10.3389/fneur.2019.01459
11. Fong, H., & Li, Y. (2024). Recapitulation of structure-function-regulation of blood–brain barrier. Frontiers in Neuroanatomy, 18, Article 34652. https://doi.org/10.3389/fnana.2024.38334652
12. Wu, D., Tian, Y., & Zhang, J. (2023). The blood–brain barrier: structure, regulation and drug delivery. Signal Transduction and Targeted Therapy, 8, Article 157. https://doi.org/10.1038/s41392-023-01481-w
13. Perez, J. M., et al. (2022). Studies reveal skull as unexpected source of brain immunity. Science News. Washington University in St. Louis.
14. Mohamed, H. M., & Dijkstra, C. D. (2023). Immune cells as messengers from the CNS to the periphery. Frontiers in Immunology, 14, Article 1233908. https://doi.org/10.3389/fimmu.2023.1233908
15. Jin, Y., & Li, Y. (2023). Microglia activation in central nervous system disorders: A review. Neuroscience Bulletin, 39(2), 213–224. https://doi.org/10.1007/s12264-023-01099-z
16. Fong, H., Li, Y. (2024). Recapitulation of structure-function-regulation of blood–brain barrier. Frontiers in Neuroanatomy, 18, Article 34652.
17. Kipnis, J., & Schwartz, M. (2021). A privileged brain. Science, 374(6566), 27–29. https://doi.org/10.1126/science.abl7122
18. Paolicelli, R. C., Bolasco, G., Pagani, F., Maggi, L., Scianni, M., Panzanelli, P., … & Gross, C. T. (2011). Synaptic pruning by microglia is necessary for normal brain development. Science, 333(6048), 1456–1458. https://doi.org/10.1126/science.1202529
19. Schafer, D. P., Lehrman, E. K., Stevens, B. (2013). The “quad-partite” synapse: Microglia-synapse interactions in the developing and mature CNS. Glia, 61(1), 24–36. https://doi.org/10.1002/glia.22354
20. Cornell, J., Salinas, S., Huang, H. Y., & Zhou, M. (2022). Microglia regulation of synaptic plasticity and learning and memory. Frontiers in Cellular Neuroscience, 16, 982760. https://doi.org/10.3389/fncel.2022.982760
21. Li, S., Shao, X., Fang, M., et al. (2024). Microglia mediate memory dysfunction via excitatory synapse loss. Frontiers in Aging Neuroscience, 16, 11406843. https://doi.org/10.3389/fnagi.2024.11406843
22. Marschallinger, J., Iram, T., Zardeneta, M., et al. (2020). Lipid droplet accumulating microglia represent a dysfunctional and pro-inflammatory state in aging and disease. Nature Neuroscience, 23(2), 194–208. https://doi.org/10.1038/s41593-019-0566-1
23. Antignano, I., Obied, M., & O’Donnell, M. A. (2023). Aging microglia. Current Opinion in Neurobiology, 83, 102733. https://doi.org/10.1016/j.conb.2023.102733
24. Li, J., & Han, X. (2022). Therapeutic targeting of microglia-mediated oxidative stress after brain injury. Frontiers in Medicine, 9, 1034692. https://doi.org/10.3389/fmed.2022.1034692
25. Jonsson, T., Stefansson, H., Steinberg, S., et al. (2013). Variant of TREM2 associated with the risk of Alzheimer’s disease. New England Journal of Medicine, 368(2), 107–116. https://doi.org/10.1056/NEJMoa1211103
26. Zhang, J., Wu, F., Li, Q., et al. (2023). Genome-wide association study in Alzheimer’s disease. Frontiers in Aging Neuroscience, 15, 1290657. https://doi.org/10.3389/fnagi.2023.1290657
27. Hashioka, S., McGeer, P. L., & McGeer, E.G. (2020). Do Alzheimer’s Disease Risk Gene Products Actually Act in Microglia? Frontiers in Aging Neuroscience, 12, 589196. https://doi.org/10.3389/fnagi.2020.589196
28. Ferrari-Souza, J. P., & Hansson, O. (2023). APOEε4 associates with microglial activation independently of amyloid and tau pathology. Science Advances, 9(15), eade1474. https://doi.org/10.1126/sciadv.ade1474
29. Liu, C., Li, Y., Wu, H., et al. (2025). The Impact of ApoE4 on Microglial Function in Alzheimer’s Disease. Cells, 14(2), 361. https://doi.org/10.3390/cells14020361
30. He, C., Chen, B., Yang, H., & Zhou, X. (2025). The dual role of microglia in Alzheimer’s disease: From immune regulation to pathological progression. Frontiers in Aging Neuroscience, 17, 1554398. https://doi.org/10.3389/fnagi.2025.1554398
31. Bemark, M., Fagarasan, S., & Caton, A. J. (2024). Gut-associated lymphoid tissue: a microbiota-driven hub for immune regulation and systemic immunity. Trends in Immunology, 45(1), 3–19. https://doi.org/10.1016/j.it.2023.11.003
32. Brandtzaeg, P., & Pabst, R. (2004). Man the barrier! Strategic defences in the intestinal mucosa. Nature Reviews Immunology, 4(10), 807–819. https://doi.org/10.1038/nri1457
33. Mowat, A. M., & Agace, W. W. (2014). Regional specialization within the intestinal immune system. Nature Reviews Immunology, 14(10), 667–685. https://doi.org/10.1038/nri3738
34. Kelly, J. R., Kennedy, P. J., Cryan, J. F., Dinan, T. G., Clarke, G., & Hyland, N. P. (2015). Breaking down the barriers: the gut microbiome, intestinal permeability and stress-related psychiatric disorders. Frontiers in Cellular Neuroscience, 9, 392. https://doi.org/10.3389/fncel.2015.00392
35. Zhu, H., Liu, S., & Ge, Y. (2025). The microbiota-gut-brain axis and central nervous system diseases. Frontiers in Microbiology, 16, 1583562. https://doi.org/10.3389/fmicb.2025.1583562
36. Wen, L., & Duffy, A. (2017). Factors Influencing the Gut Microbiota, Inflammation, and Type 2 Diabetes. The Journal of Nutrition, 147(7), 1434S–1438S. https://doi.org/10.3945/jn.116.240513
37. Benakis, C., Brea, D., Caballero, S., et al. (2016). Stroke affects intestinal immune cell trafficking to the central nervous system. Frontiers in Neuroscience, 10, 282. https://doi.org/10.3389/fnins.2021.642753
38. Wang, Y., Chen, X., Ma, L., et al. (2025). The role of gut microbiota dysbiosis in drug-induced brain injury: microbiome–gut–brain axis contributions. Frontiers in Cellular and Infection Microbiology, 15, 1604539. https://doi.org/10.3389/fcell.2025.1604539
39. Silva, Y. P., Bernardi, A., & Frozza, R. L. (2020). The Role of Short-Chain Fatty Acids from Gut Microbiota in Gut-Brain Communication. Frontiers in Endocrinology, 11, 25. https://doi.org/10.3389/fendo.2020.00025
40. Caetano-Silva, M. E., et al. (2023). Inhibition of inflammatory microglia by dietary fiber and short-chain fatty acids. Scientific Reports, 13, 27086. https://doi.org/10.1038/s41598-022-27086-x
41. Li, S., et al. (2023). Modulation of immunity by tryptophan microbial metabolites. Frontiers in Nutrition, 10, 1209613. https://doi.org/10.3389/fnut.2023.1209613
42. Wu, S., et al. (2021). Roles and Mechanisms of Gut Microbiota in Patients With Alzheimer’s Disease. Frontiers in Aging Neuroscience, 13, 663354. https://doi.org/10.3389/fnagi.2021.663354
43. Lan, Z., et al. (2024). The role of short-chain fatty acids in central nervous system diseases. Frontiers in Cellular Neuroscience, 18, 10906301. https://doi.org/10.3389/fncel.2024.10906301
44. , R. D., et al. (2011). Normal gut microbiota modulates brain development and behavior. PNAS, 108(7), 3047–3052. https://doi.org/10.1073/pnas.1010529108
45. Zhan, Y., et al. (2023). The potential of the gut microbiome for identifying Alzheimer’s disease. Frontiers in Neuroscience, 17, 1130730. https://doi.org/10.3389/fnins.2023.1130730
46. Caetano-Silva, M. E., et al. (2023). Dietary fiber and SCFA inhibition of inflammatory microglia. Scientific Reports, 13, 27086. https://doi.org/10.1038/s41598-022-27086-x
47. Preprint: Interaction of Gut-Microbial Amyloids with Endogenous Amyloids Drives Pro-inflammatory Microglia in Alzheimer’s Disease. bioRxiv. https://doi.org/10.1101/2025.01.15.633290
48. Bonaz, B., Bazin, T., & Pellissier, S. (2018). The Vagus Nerve at the Interface of the Microbiota-Gut-Brain Axis. Frontiers in Neuroscience, 12, 49. https://doi.org/10.3389/fnins.2018.00049
49. Kressel, A. M., Tsaava, T., Levine, Y. A., et al. (2020). Identification of a brainstem locus that inhibits tumor necrosis factor. PNAS, 117(47), 29803–29810. https://doi.org/10.1073/pnas.2008213117
50. Koopman, F. A., Chavan, S. S., Miljko, S., et al. (2016). Vagus nerve stimulation inhibits cytokine production and attenuates disease severity in rheumatoid arthritis. PNAS, 113(29), 8284–8289. https://doi.org/10.1073/pnas.1605635113
51. Tracey, K. J. (2002). The inflammatory reflex. Nature, 420(6917), 853–859. https://doi.org/10.1038/nature01321
52. Liu, C.-H., Wang, R., Zhou, J., et al. (2025). Mechanisms of vagus nerve stimulation for the treatment of neuroimmune and neuropsychiatric disorders. Frontiers in Neuroscience, 18, 1527842. https://doi.org/10.3389/fnins.2024.1527842
53. Randich, A., & Gebhart, G. F. (1992). Vagal afferent modulation of immune function. Trends in Neurosciences, 15(9), 406–411.
54. Bonaz, B. L., Sinniger, V., Pellissier, S. (2017). Vagus nerve stimulation: a new promising therapeutic tool in inflammatory bowel disease. Journal of Internal Medicine, 282(1), 46–63.
55. Furness, J. B. (2012). The enteric nervous system and neurogastroenterology. Nature Reviews Gastroenterology & Hepatology, 9(5), 286–294. https://doi.org/10.1038/nrgastro.2012.32
56. Bellono, N. W., Bayrer, J. R., Leitch, D. B., et al. (2017). Enteroendocrine cells sense microbial metabolites to trigger neural circuits. Cell, 170, 185–198. https://doi.org/10.1016/j.cell.2017.05.034
57. Dohnalová, L., Martinez-Gili, L., Dumas, M. E., et al. (2022). A microbiome-dependent gut–brain pathway regulates exercise motivation. Nature, 612(7938), 739–747. https://doi.org/10.1038/s41586-022-05477-9
58. O’Riordan, K. J., Sandhu, K., Lyons, K., et al. (2025). The gut microbiota-immune-brain axis. Frontiers in Neurology, 12, 721126. https://doi.org/10.3389/fneur.2021.721126
59. F., Solfrizzi, V., Barulli, M. R., et al. (2025). The role of the Mediterranean diet in reducing the risk of cognitive impairment and Alzheimer’s disease: A systematic review and meta-analysis. Journal of Nutrition, Health and Aging, 29(6), 523–536. https://doi.org/10.1007/s12603-025-2003-7
60. Mediterranean diet, which prioritizes plant-based foods, healthy fats, and minimizes processed sugars and saturated fats.
61. National Institute on Aging. (2023). MIND and Mediterranean diets linked to fewer signs of Alzheimer’s brain pathology. NIA News.
62. Park, S.-Y., et al. (2025). MIND diet may lower risk of Alzheimer’s disease at any age. University of Hawaiʻi Cancer Center News.
63. Morris, M. C., Tangney, C. C., Wang, Y., et al. (2015). MIND diet associated with reduced incidence of Alzheimer’s disease. Alzheimer’s & Dementia: The Journal of the Alzheimer’s Association, 11(9), 1007–1014. https://doi.org/10.1016/j.jalz.2014.11.009
64. Glenn, M. E., Wang, D. D., et al. (2025). Alzheimer’s: Could a Mediterranean diet help offset genetic risk? Medical News Today (reporting on Wang et al. 2025 study).
65. Huhn, S., Kharabian Masouleh, S., Stumvoll, M., Villringer, A., & Witte, A. V. (2015). Components of a Mediterranean diet and their impact on cognitive functions in aging. Frontiers in Aging Neuroscience, 7, 132. https://doi.org/10.3389/fnagi.2015.00132
66. Picone, P., et al. (2024). Enriching the Mediterranean diet could nourish the brain: neuroprotective effects of its components. Neuroscience Letters, 818, 136599. https://doi.org/10.1016/j.neulet.2023.136599
67. Tran, D. M. D., et al. (2025). Consumption of a diet high in fat and sugar is associated with cognitive decline: Evidence from epidemiological studies. International Journal of Obesity, 49(1), 50–63. https://doi.org/10.1038/s41366-025-01776-8
68. Beilharz, J. E., Maniam, J., & Morris, M. J. (2015). Diet-Induced Cognitive Deficits: The Role of Fat and Sugar, Potential Mechanisms, and Nutritional Interventions. Frontiers in Behavioral Neuroscience, 9, 152. https://doi.org/10.3389/fnbeh.2015.00152
69. Furusawa, Y., Obata, Y., Fukuda, S., et al. (2014). Commensal microbe–derived butyrate induces the differentiation of colonic regulatory T cells. Nature, 504(7480), 446–450. https://doi.org/10.1038/nature12721
70. Fock, E., & Parnova, R. (2023). Mechanisms of blood-brain barrier protection by microbiota-derived short-chain fatty acids. Cells, 12(4), 657. https://doi.org/10.3390/cells12040657
71. Yu, C., et al. (2022). Pharmacological effects of polyphenol phytochemicals on NF-κB signaling pathway in inflammatory diseases. Frontiers in Pharmacology, 13, 932641. https://doi.org/10.3389/fphar.2022.932641
72. Akanyibah, F. A., et al. (2025). The role of plant-based dietary compounds in gut microbiota modulation in inflammatory bowel disease. Frontiers in Nutrition, 12, 1606289. https://doi.org/10.3389/fnut.2025.1606289
73. Tran, N. Q., & Drougard, A. (2025). Omega-3 fatty acids and fetal brain development. Exploration of Neuroprotective Therapies, 4(2), 107–119. https://doi.org/10.37349/ent.2025.00027
74. Bryant, C., et al. (2024). Scientists identify how fasting may protect against inflammation. Cell Reports, 42(2), 108268.
75. Beilharz, J. E., Maniam, J., & Morris, M. J. (2015). Diet-Induced Cognitive Deficits: The Role of Fat and Sugar, Potential Mechanisms, and Nutritional Interventions. Frontiers in Behavioral Neuroscience, 9, 152. https://doi.org/10.3389/fnbeh.2015.00152
76. Tran, D. M. D., et al. (2025). Consumption of a diet high in fat and sugar is associated with cognitive decline: Evidence from epidemiological studies. International Journal of Obesity, 49(1), 50–63. https://doi.org/10.1038/s41366-025-01776-8
77. Hernández-Rodríguez, M., González-Ortiz, M., & Martínez-Abundis, E. (2023). Obesity and Blood–Brain Barrier Dysfunction: Implications for Cognitive Decline and Dementia. International Journal of Molecular Sciences, 24(6), 5859. https://doi.org/10.3390/ijms24065859
78. Hao, S., et al. (2023). High-fat diet–induced obesity increases permeability of the blood-brain barrier, exacerbates neuroinflammation, and impairs cognition. Nutrients, 15(2), 389. https://doi.org/10.3390/nu15020389
79. Glenn, M. E., Wang, D. D., et al. (2025). Alzheimer’s: Could a Mediterranean diet help offset genetic risk? Medical News Today (reporting Wang et al. 2025).
80. Panaitescu, P.Ș., Marinescu, B., Pîrvu, D., et al. (2024). The Effect of Gut Microbiota-Targeted Interventions on Neuroinflammation and Motor Outcomes in Animal Models of Parkinson’s Disease: A Systematic Review and Meta-Analysis. Frontiers in Neuroscience, 18, 38785512. https://doi.org/10.3389/fnins.2024.38785512
81. Huwart, S. J. P., et al. (2025). Gut microbiota-related neuroinflammation at the crossroad of neurological and psychiatric disorders. Gut, Early View. https://doi.org/10.1136/gutjnl-2024-333397
82. Paudel, D., et al. (2024). Gastrointestinal microbiota-directed nutritional and therapeutic interventions: Effectiveness and challenges. Nutrients, 16(5), 11057942. https://doi.org/10.3390/nu160510942
83. Loh, J. S., et al. (2024). Microbiota–gut–brain axis and its therapeutic applications in neurodegenerative and psychiatric disorders. Signal Transduction and Targeted Therapy, 9, Article 1743. https://doi.org/10.1038/s41392-024-01743-1
84. Hitch, T. C. A., et al. (2022). Microbiome-based interventions to modulate gut ecology and host health. Current Opinion in Microbiology, 68, 42–52. https://doi.org/10.1016/j.mib.2022.08.008
85. Asaoka, D., et al. (2025). The Effect of Prebiotics and Probiotics on Levels of Depression, Anxiety, and Cognitive Function: A Meta-Analysis. Nutrients, 17(3), 11879892. https://doi.org/10.3390/nu17030719
86. Park, K. J., Gao, Y., et al. (2024). Gut-brain axis and neurodegeneration: mechanisms and therapeutic potentials. Frontiers in Neuroscience, 18, 1481390. https://doi.org/10.3389/fnins.2024.1481390
87. Reich, N., & Hölscher, C. (2022). The neuroprotective effects of glucagon-like peptide 1 in Alzheimer’s and Parkinson’s disease: An in-depth review. Frontiers in Neuroscience, 16, 970925. https://doi.org/10.3389/fnins.2022.970925
88. Lv, D. et al. (2024). Neuroprotective effects of GLP-1 class drugs in Parkinson’s disease. Frontiers in Neurology, 15, 1462240. https://doi.org/10.3389/fneur.2024.1462240
89. Fock, E., & Parnova, R. (2023). Anti-Inflammatory Effects of GLP-1 Receptor Activation in the Brain: Implications for neurodegeneration and other diseases. International Journal of Molecular Sciences, 24(16), 12463. https://doi.org/10.3390/ijms241612463
90. Decourt, B., et al. (2017). TNF-α & Microglia in Neurodegenerative Diseases. Biospective, March 27, 2025.
91. Peter, I., et al. (2018). Anti–Tumor Necrosis Factor Therapy and Incidence of Parkinson Disease. JAMA Neurology, 75(9), 963-969. https://doi.org/10.1001/jamaneurol.2018.0682
92. Fadl, M., et al. (2023). Platelet factors attenuate inflammation and rescue cognition in ageing. Nature, 619, 56-63. https://doi.org/10.1038/s41586-023-06436-3
93. Carnevale, L., et al. (2023). Neuroimmunomodulation of vagus nerve stimulation and implications for inflammation. Frontiers in Aging Neuroscience, 15, 1173987. https://doi.org/10.3389/fnagi.2023.1173987
94. Herrmann, C. S., Rach, S., Neuling, T., & Strüber, D. (2013). Transcranial alternating current stimulation: a review of the underlying mechanisms and modulation of cognitive processes. Frontiers in Human Neuroscience, 7, 279. https://doi.org/10.3389/fnhum.2013.00279
95. Olofsson, P. S., & Tracey, K. J. (2017). Bioelectronic medicine: technology targeting molecular mechanisms for therapy. The Journal of Internal Medicine, 282(1), 3–17. https://doi.org/10.1111/joim.12611
96. Hours, C., Carnevale, L., et al. (2025). Probing neural and immune pathways in brain disorders: New targets for neuromodulation. Current Opinion in Neurobiology, 81, 12038965. https://doi.org/10.1016/j.conb.2025.12038965